1. Úvod
Postavení scintigrafie v diagnostických algoritmech spojených s vyšetřením CNS se v průběhu času významně změnilo. Radionuklidové metody původně sloužící v období před nástupem CT a MRI k primární diagnostice lokalizace ložiskových lézí mozku (na základě detekce ložiskové poruchy hematoencefalické bariéry) slouží nyní především k funkční a metabolické diagnostice procesů postihujících CNS.
Nejčastěji se hodnotí:
- Rozložení regionální perfúze mozkové tkáně.
- Rozložení receptorů a transportérů v mozku.
- Rozložení metabolismu glukózy, proliferační aktivity nebo proteozyntézy v mozkové tkáni a nádorech postihujících CNS.
- Cirkulace mozkomíšního moku.
2 . Radiofarmaka
V závislosti na typu procesu, který chceme hodnotit, se využívají různá radiofarmaka. Jde o sloučeniny, které se vychytávají v mozkové tkáni v závislosti na určitém fyziologickém nebo patofyziologickém ději. Jsou označeny radionuklidy, které lze detekovat SPECT nebo PET vyšetřením.
Podle mechanismu, kterým se řídí jejich distribuce v CNS, je lze rozdělit na radiofarmaka zobrazující poruchu hematoencefalické bariéry, intenzitu perfúze mozku, rozložení receptorů a transportérů v mozku, intenzitu metabolických procesů v mozku a cirkulaci mozkomíšního moku.
2.1. Radiofarmaka pro detekci ložiskových poruch integrity hematoencefalické bariéry
Do nejstarší generace radiofarmak sloužících ke scintigrafickému vyšetření mozku patří sloučeniny nepronikající neporušenou hematoencefalickou bariérou. Průkaz případné akumulace takového radiofarmaka v mozku znamená, že v dané oblasti je hematoencefalická bariéra porušena. Představitelem této skupiny radiofarmak jsou 99mTc-DTPA a 99mTc-technecistan.. Tato vyšetření se v současné době však již používají jen výjimečně.
2.2. Radiofarmaka pro hodnocení perfúze mozku
Radiofarmaka sloužící k zobrazení rozložení a intenzity perfúze mozku se na pracoviště nukleární medicíny dodávají ve formě substancí, které se teprve v radiofarmaceutické laboratoři pracoviště nukleární medicíny značí 99mTc.
Radiofarmaka používaná k posouzení prokrvení mozkové tkáně musí splňovat následující kritéria:
- Schopnost průniku neporušenou hematoencefalickou bariérou,
- Vysoká extrakce při prvním průtoku mozkem,
- Dostatečně dlouhodobá retence sloučeniny v mozkové tkáni bez významné redistribuce.
Uvedené požadavky nejlépe splňují lipofilní sloučeniny schopné proniknout přes hematoencefalickou bariéru do mozkových buněk, které v intracelulárním prostředí neuronů nabývají hydrofilní charakter a které od tohoto okamžiku již nejsou schopny hematoencefalickou barierou pronikat nazpět. Tímto způsobem tedy dojde k zafixování „obrazu“ perfúze mozku z okamžiků těsně navazujících na i.v. podání radiofarmak, přičemž vlastní scintigrafii lze provést až v následném období (do 1 hodiny od aplikace radiofarmaka).
Míra akumulace perfúzního radiofarmaka v mozkové tkáni obecně závisí:
- Na intenzitě průtoku krve mozkem, která je závislá na stavu cévního řečiště a na úrovni regionálního metabolismu CNS,
- Na viabilitě buněčných struktur mozku.
V současné době se používá k hodnocení perfúze mozku 99mTc-HMPAO (hexamethylpropylenaminooxim) a 99mTc-ECD (bicisát).
Konverze v hydrofilní formu je u 99mTc-HMPAO pasivní děj nastávající pod vlivem intracelulární prostředí. U moderních radiofarmak obsahujících 99mTc-HMPAO byla odstraněna přirozená nestabilita preparátu, v jejímž důsledku byla maximální možná doba mezi přípravou radiofarmaka a jeho podáním velmi krátká (jen půl hodiny). Nové diagnostické soupravy umožňují prodloužit dobu mezi přípravou radiofarmaka a jeho aplikací pacientovi na 4 a více hodin, což je důležité především při diagnostice epileptického ložiska, kdy je třeba podat radiofarmakum na počátku epileptického záchvatu.
Přeměna v hydrofilní formu u 99mTc-ECD nastává deesterifikací, což je aktivní proces vyžadující přítomnost životaschopné mozkové tkáně. Výhodou tohoto radiofarmaka je jeho velmi rychlá clearance z měkkých tkání hlavy, což umožňuje dosáhnou potřebného vysokého kontrastu mezi mozkovou tkání a tělovým pozadím. Chemická stabilita 99mTc-ECD je vysoká, doba od přípravy radiofarmaka do jeho aplikace může být až 8 hodin.
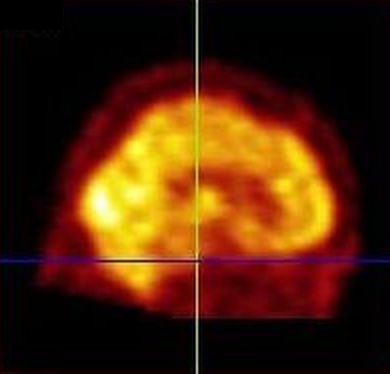
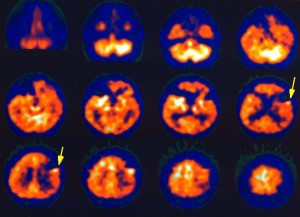
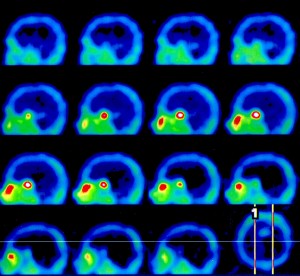
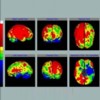
Intenzita prokrvení mozkové tkáně závisí na její aktivitě. Logickým důsledkem této skutečnosti je stav, kdy se při perfúzní scintigrafii mozku dobře zobrazuje šedá hmota mozková a bílá hmota mozková je zobrazena jen chabě (obr. 1).
Obr. 1 Perfúzní scintigrafie mozku 99mTc-ECD u pacienta po prodělané CMP. Je viditelý defekt vlevo temporoparietálně.
2.3. Radiofarmaka k zobrazení distribuce a množství receptorů v CNS
Nověji se do klinické praxe prosadila radiofarmaka umožňující hodnotit metabolismus dopaminu v bazálních gangliích.
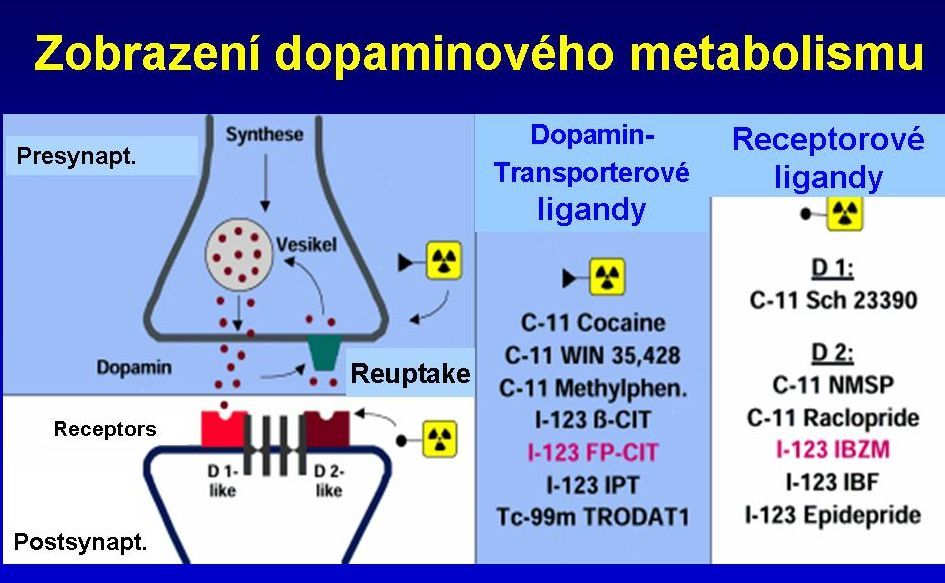
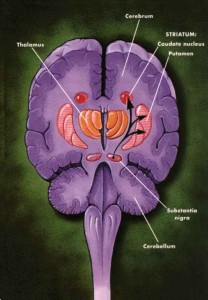
Na synapsích v bazálních gangliích se vyskytují postsynapticky lokalizované dopaminové receptory, na presynaptické membráně jsou i dopaminové transportéry, které slouží ke zpětnému vychytání dopaminu uvolněného do synaptické štěrbiny tak, aby byl dopamin připraven pro opětné uvolnění při příchodu dalšího signálu.
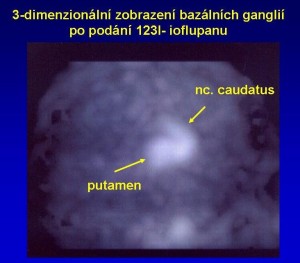
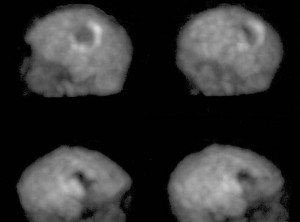
Distribuci dopaminových transportérů v bazálních gangliích lze zobrazit pomocí analogů kokainu, například pomocí 123I-ioflupanu.
Rozložení a množství postsynaptických dopaminových D2 receptorů lze zobrazit pomocí 123I-IBZM (jodbenzamid) nebo 123I-epidepridu.
Obr. 2a Schématické znázornění dopaminergní synapse v bazálních gangliích. Dopaminové transportéry a receptory a příklady radiofarmak.
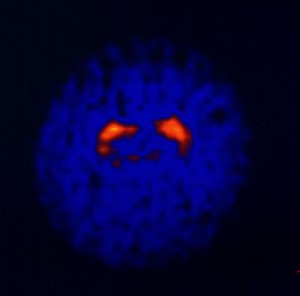
Obr. 2b Třídimenzionální scintigrafické zobrazení dopaminových transportérů v bazálních gangliích. 123I-Ioflupan SPECT normálních bazálních ganglií.
2.4. Radiofarmaka sloužící k zobrazení metabolismu
Mozková tkáň využívá glukózu jako hlavní zdroj energie a i v případě nervové tkáně lze intenzitu metabolismu glukózy zobrazit pomocí PET vyšetření s použitím 18F-FDG. Úroveň utilizace glukózy v mozkové tkáni závisí na její funkční aktivitě a na jejím prokrvení. Důsledkem této skutečnosti je stav obdobný jako při perfúzní scintigrafii – dobře se zobrazuje šedá hmota mozková, bílá hmota mozková je zobrazena jen chabě.
Utilizace 18F-FDG je zvýšená i v high-grade gliomech (grade III-IV) a v mozkových metastázách při jiných malignitách. Bohužel v situaci, kdy i okolní šedá hmota mozková intenzivně vychytává glukózu, je kontrast mezi maligní tkání a šedou hmotou mozkovou často jen chabý.
Ke zobrazení nádorové tkáně v mozku se přednostně využívají radiofarmaka zobrazující proliferační aktivitu nebo proteosyntézu, která nevykazují významnou akumulaci v normální mozkové tkáni. K zobrazení proliferační aktivity lze využít nukleosid thymidinu značený 18F (18F-FLT). K zobrazení proteosyntézy se lze využít tyrosin značený 18F (18F-alfa-methyl-tyrosin pro PET) nebo 123I (123I-tyrosin pro SPECT).
2.5. Radiofarmaka pro zobrazeními cirkulace mozkomíšního moku
K zobrazení toku mozkomíšního moku se používá 111In-DTPA. DTPA je chelát, který se vstřebává společně s mozkomíšním mokem pouze v arachnoideálních granulacích, a to především v oblasti sinus sagitalis superior. Vzhledem k tomu, že tok mozkomíšního moku je pomalý, nelze k označení DTPA použít 99mTc, jehož poločas 6 hodin je příliš krátký pro vyšetření, které je delší než 24 hodin. K označení DTPA se proto využívá 111In (indium), které má dostatečně dlouhý poločas (67 hodin), i když energie jeho gama fotonů je pro scintigrafii méně vhodná.
3. Metodika tomografických vyšetření mozku (SPECT a PET)
Pro správné provedení radionuklidových vyšetření mozku je důležité dodržovat přesná pravidla týkající se způsobu aplikace radiofarmaka pacientům, provedení vlastní scintigrafie i zásad hodnocení vyšetření.
3.1. Aplikace radiofarmaka
Protože perfúze i metabolismus mozku jsou závislé nejen na kvalitě cévního řečiště, ale i na funkční aktivitě mozku, je nutno radiofarmaka 99mTc-HMPAO, 99mTc-ECD a 18FDG aplikovat za standardních podmínek. Aby byl minimalizován vliv variability funkční aktivity mozkové tkáně, který by mohl zkreslit výsledek vyšetření, je třeba radiofarmakum podávat ve zšeřelé místnosti s potlačením všech smyslových podnětů. K eliminaci bolestivého podnětu při aplikaci je vhodné zavést nitrožilní kanylu v dostatečném časovém předstihu před vlastním podáním radiofarmaka.
Méně často se provádějí vyšetření při cílené aktivaci některé části mozkové kůry, jde především o studie prováděné z psychiatrických indikací (používají se stimulace verbální, zrakové, motorické atd.).
3.2. Vlastní SPECT a PET vyšetření
K přesnému posouzení rozložení radiofarmak v mozku je nutno použít adekvátní tomografickou techniku SPECT nebo PET. Pro SPECT vyšetření je doporučeno používat dvou-, případně třídetektorové kamery, které umožňují časově efektivní provedení vyšetření s maximálně možnou kvalitou vyšetření. Vyšetření PET je optimální provádět na hybridních PET/CT přístrojích umožňujících přesnou korelaci PET nálezu s anatomickým substrátem.
Během tomografických vyšetření je nutno fixovat hlavu pacienta tak, aby nedošlo ke zkreslení obrazu následkem pohybů hlavy pacienta.
Při SPECT i PET vyšetřeních se vytvářejí tomografické řezy v transverzálních, koronálních a sagitálních rovinách; transverzální řezy jsou reorientovány tak, aby se co nejvíce blížily bikomisurální rovině zvykle používané při CT a MRI vyšetřeních. Při cíleném vyšetření temporálních laloků (především při pátrání po epileptickém ložisku) se transverzální rovina prokládá do průběhu podélných os temporálních laloků.
Obr. 3a. Průběh transverzální roviny při standardním způsobu vyšetření. Obr. 3b. Průběh transverzální roviny uložené do roviny temporálních laloků.
3.3. Hodnocení tomografických vyšetření mozku
Výsledkem vyšetření jsou série tomografických řezů mozkem ve 3 základních rovinách – transverzální, koronální a sagitální.
Tomografické řezy mozkem se hodnotí:
- Vizuálně se snahou detekovat zřetelné ložiskové defekty a případnou asymetrii v zobrazení hemisfér (obr. 1)
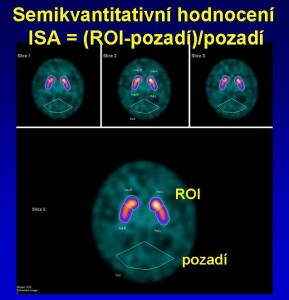
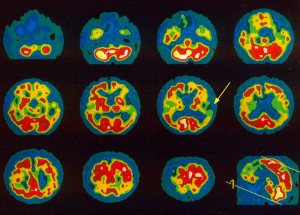
- Semikvantitativně, kdy se provádí stranové srovnání počtu impulzů v jednotlivých oblastech a srovnání četnosti impulzů v jednotlivých oblastech s referenční oblastí (například mozečkem) (obr. 4)
- Semikvantitativně, kdy se s pomocí aplikace statistických principů provádí srovnání aktuální distribuce radiofarmaka s normálovým souborem nebo s nálezem u stejného pacienta získaným za jiných podmínek (srovnání nálezu za stimulace a v klidu) – příkladem uvedeného principu je „statistické parametrické mapování“.
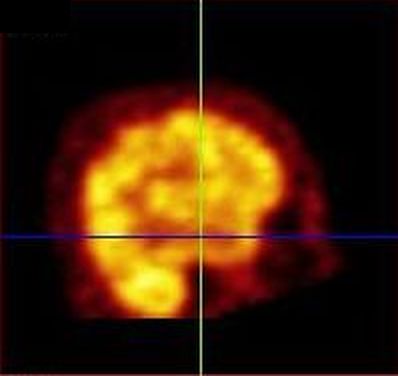
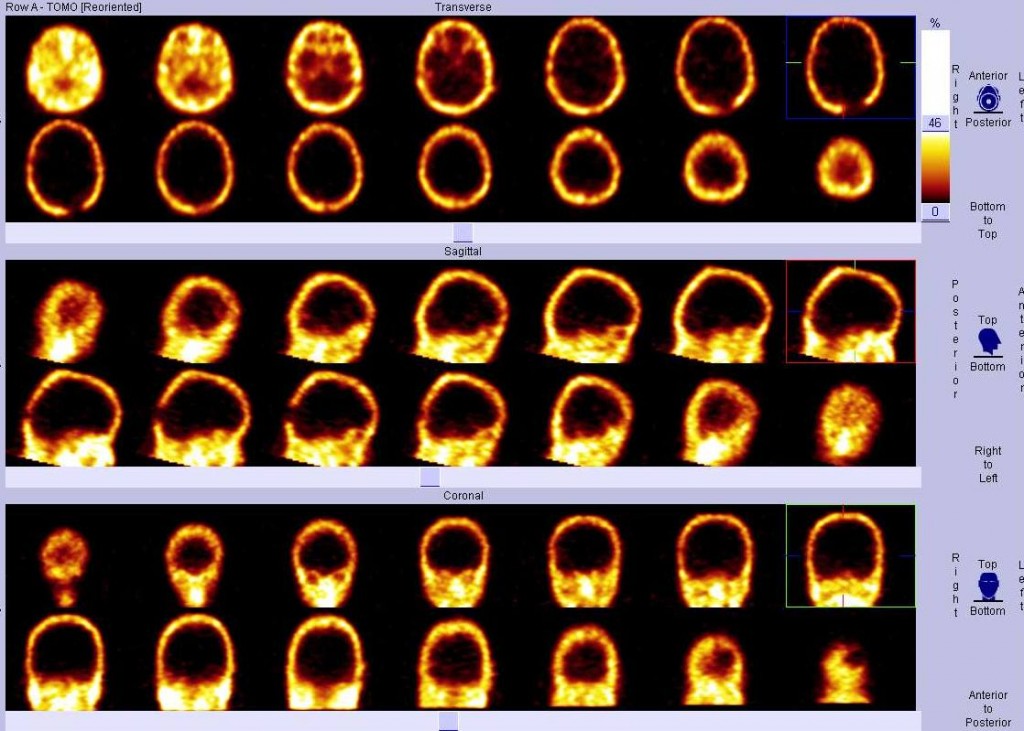
Obr. 4 Semikvantitativní hodnocení perfúze mozku na tomografickém řezu 99mTc-HMPAO (pacient s demencí s Lewyho tělísky) – zobrazení tomografických řezů v desetistupňové barevné škále. Je patrná hypoperfúze parietálně.
Obr. 5 Semikvantitativní hodnocení denzity dopaminových transportérů v bazálních gangliích – stanovení „indexu specifické aktivity“.
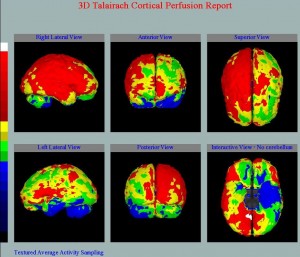
Obr. 6. Semikvantitativní 3D hodnocení perfúze mozku 99mTc-ECD programem Neurogam u pacienta s relativní hypoperfúzí.
4. Typy radionuklidových vyšetření CNS
Radionuklidová vyšetření CNS umožňují:
- Hodnocení perfúze mozku
- Zobrazení distribuce receptorů a transportérů synapsích mozku.
- Vyšetření metabolismu CNS a detekci tumorů a jejich reziduí v mozkové tkáni.
- Sledovat cirkulaci mozkomíšního moku.
4.1. Perfúzní scintigrafie mozku
Perfúze mozku je závislá na stavu cévního řečiště, který by měl umožnit dostatečný přítok krve. Druhým důležitým faktorem ovlivňující prokrvení mozkové tkáně je její funkční aktivita.
K zobrazení perfúze mozku se využívá SPECT vyšetření po předchozím podání radiofarmak 99mTc-HMPAO a 99mTc-ECD.
Indikacemi perfúzní scintigrafie jsou cerebrovaskulární onemocnění, mozková smrt, diferenciální diagnostika demencí a detekce epileptického ložiska.
4.1.1. Cerebrovaskulární onemocnění
SPECT vyšetření perfúze mozku je schopno stanovit rozsah ischemické léze již v časné fázi ischemické cévní mozkové příhody (dříve než při CT provedeném standardním způsobem). Přesto se toto vyšetření nestalo zcela obvyklou součástí diagnostického algoritmu péče o pacienty s čerstvou cévní mozkovou příhodou, protože nevýhodou SPECT vyšetření je časová náročnost vyšetření a její horší dostupnost ve srovnání s CT.
Ischemické i hemorhagické ložisko v mozkové tkáni se při perfúzní scintigrafi mozku zobrazí jako oblast bez akumulace radiofarmaka, protože radiofarmakum nepronikne do postižené oblasti.
Při vyšetření pomocí 99mTc-HMPAO se v úvodním období po cévní mozkové příhodě zobrazuje vlastní ložisko podléhající nekróze jako oblast bez akumulace radiofarmaka, na periférii ložiska se však zobrazuje tkáň, která je sice poškozena (je zde porušena hematoencefalická bariéra), ale je v ní částečně zachováno prokrvení. V této oblasti paradoxně dochází ke zvýšenému vychytávání radiofarmaka, než je tomu v okolí, protože porušená hematoencefalická bariéra umožňuje intenzivnější průnik radiofarmaka do tkáně. Takový nález zvýšené akumulace radiofarmaka se označuje anglickým termínem „luxury perfusion“ (obr. 7): Jde o oblast, ve které při adekvátní terapii může dojít k zachování životaschopné mozkové tkáně.
Obr. 7a,b. Subakutní cévní mozková příhoda s obrazem „luxury perfusion“. 99mTc-HMPAO perfúzní scintigrafie mozku 10 dní po cévní mozkové příhodě parietálně vlevo s obrazem „luxury perfusion“ (lem hyperakumulace radiofarmaka kolem ložiskového defektu označen šipkou), stav po starší cévní příhodě frontoparietálně vpravo. Obr. 7a (vlevo) – transverzální řezy, 7b (vpravo) – třídimenzionální obraz.
Po cévní mozkové příhodě se mění rozložení funkční aktivity v mozkové tkáni. Typickým příkladem je snížení funkční aktivity v mozečkové hemisféře kontralaterální ke straně cévní mozkové příhody v důsledku porušení kortikopontocerebelárních drah. Snížení funkční aktivity mozkové tkáně vede i ke snížení její perfuze (při nižší aktivitě stačí jen i méně intenzivní prokrvení této tkáně). Funkčně zapříčiněná chabější perfuze kontralaterální mozečkové hemisféry se označuje jako „zkřížená mozečková diaschýza“. Na rozdíl od „luxury perfusion“ se „zkřížená mozečková diaschýza“ zobrazuje i při vyšetření 99mTc-ECD.
SPECT vyšetření perfuze mozku je považováno za metodu schopnou prokázat dočasné porušení mozkového prokrvení při tranzitorní ischemické mozkové atace (TIA). Při této mozkové příhodě nedochází k morfologickým změnám v tkáni CNS. K úspěšné detekci TIA je však nutno provést scintigrafické vyšetření včasně, po 24 hodinách od vzniku TIA klesá významně senzitivita metody (obr.8).
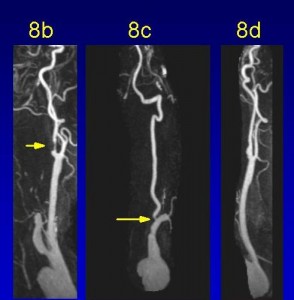
Obr. 8 Hypoperfúze po tranzitorní ischemické atace (TIA). 99mTc-ECD perfúzní SPECT u pacienta po TIA v povodí ACM l. sin. (nesystematické vertigo trvající 3 hodiny s parestéziemi na pravé horní i dolní končetině bez parézy) s úpravou ad integrum. Obr. 8a: Hypoperfúze v povodí ACM bilat., výrazněji vlevo (viz šipka). Srovnej s obr. 8b-d dole.
Obr. 8 Hypoperfúze po tranzitorní ischemické atace (TIA). Obr. 8b-d: MR angiografie. Obr. 8b. Hemodynamicky významná stenóza ACI l. dx. Obr. 8c. Filiformní stenóza a. vertebralis l. dx. Obr. 8d. Stenóza na hranici hemodynamické významnosti ACI l. sin. SPECT v tomto případě lépe odpovídá klinickému obrazu než MR AG, nález svědčí pro zachovaný průtok krve Willisovým okruhem.
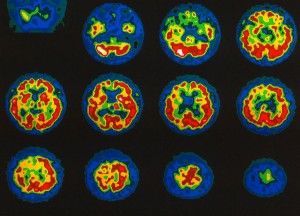
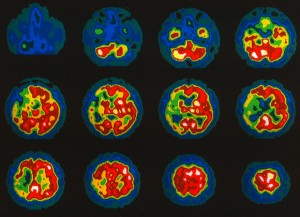
Nejvýznamnější indikací perfúzní scintigrafie mozku u pacientů s cerebrovaskulárními onemocněními je vyšetření cerebrovaskulární perfúzní rezervy. Při tomto vyšetření se pacient uvede do stavu acidózy s nadbytkem iontů HCO3- buď inhalací CO2, nebo i.v. podáním acetazolamidu blokujícím enzym karbonátdehydratázu (karboanhydrázu). V této situaci dochází za normálních okolností k dilataci mozkových cév a ke zvýšení průtoku krve mozkem. Cévní řečiště za stenotickou arterií je však již za bazálních podmínek ve stavu maximální dilatace, aby byl dle možností kompenzován efekt stenózy artérie zásobující mozkovou tkáň. Hyperkapnie proto již nevede v tomto případě ke zvýšení mozkové perfúze a na scintigramu se tento nález projeví jako oblast relativní hypoperfúze. Relativně hypoperfundovaný okrsek na SPECT ve stavu hyperkapnie odpovídá okrsku mozku se sníženou perfúzní rezervou (obr. 9).
Obr. 9. Průkaz snížené cerebrovaskulární perfúzní rezervy – acetazolamidový test. Snížená cerebrovaskulární perfúzní rezervy v povodí a. cerebri media l. dx. u pacienta s četnými tranzitorními ischemickými atakami pomocí 99mTc-HMPAO perfúzní scintigrafie mozku s acetazolamidovým testem. Obr. 9a (vlevo) – bazální vyšetření – transverzální řezy v desetistupňové barevné škále; obr. 9b (vpravo) – vyšetření po aplikaci acetazolamidu – v desetistupňové barevné škále (relativní hypoperfúze v povodí a. cerebri media l. dx.)
Toto vyšetření hraje svoji roli při rozhodování o indikaci invazivního výkonu, jestliže je jinými zobrazovacími metodami prokázána stenóza arterie zásobující mozek. I těžká stenóza a. carotis interna může být kompenzována kolaterálním oběhem ve Willisově okruhu tak dobře, že nedochází k výrazné redukci perfuze příslušné mozkové hemisféry – v tomto případě není chirurgický výkon indikován.
Řada neurochirurgických pracovišť využívá perfúzní scintigrafii mozku před zákroky, které jsou spojeny s trvalým uzávěrem a. carotis interna (například při operacích tumorů). Pokud by scintigrafie při krátkodobém uzávěru a. carotis int. prokázala, že uzavření karotického řečiště není kompenzovatelné přes cévy Willisova okruhu a vede ke vzniku zřetelného perfúzního defektu, pak je nutno zvážit alternativní postupy, protože by v této situaci následkem operace hrozilo těžké neurologické postižení.
4.1.2. Mozková smrt
Ověření mozkové smrti je nutným předpokladem pro možnost provést odběrů orgánů k následné transplantaci. Mechanismem, který vede k mozkové smrti, je edém mozku a s ním spojená blokáda průtoku krve mozkem.
Perfúzní scintigrafie mozku je neinvazivní alternativou angiografické diagnostiky mozkové smrti.
Z uvedeného vyplývá, že nálezem, který spolehlivě prokazuje mozkovou smrt, je absolutní nepřítomnost akumulace perfúzního radiofarmaka (99mTc-HMPAO nebo 99mTc-ECD) v mozku. Vyšetření se skládá z dynamické scintigrafie sledující průtok radiofarmaka oblastí hlavy a z následného SPECT vyšetření mozku. Při diagnóze mozkové smrti nesmí být při SPECT prokazatelná akumulace radiofarmaka v žádné z částí mozku.
Obr. 10 Smrt mozku – chybění akumulace 99mTc-ECD v mozku.
4.1.3 Diferenciální diagnostika demencí
Se zvyšujícím se průměrným věkem populace narůstá význam správné diagnostiky demencí. Perfúzní SPECT vyšetření mozku a 18F-FDG PET jsou schopny zobrazit postižené oblasti mozku a ve vybraných případech přispět k diferenciální diagnostice demencí.
Dle lokalizace a charakteru postižení lze odlišovat typy nálezů příslušné posteriornímu, frontotemporálnímu a vaskulárnímu typu demence.
Typickým představitelem posteriorní demence je Alzheimerova demence, pro kterou je typický nález difúzního snížení perfúze a metabolizmu v kůře temporálních až parietálních laloků, v terminální fázi je postižen i kortex laloků frontálních. Dobrá perfúze je zachována i v pokročilých fázích onemocnění ve vizuálním kortexu okcipitálních laloků. Obraz posteriorního typu demence se vyskytuje i u demence s Lewyho tělísky (Lewyho tělíska v mozkovém kortexu) a u demence při Parkinsonově chorobě.
Představitelem frontotemporálního typu demence s postižení především frontálního laloku je Pickova choroba.
Pro vaskulární typ demence jsou typické fokální perfúzní defekty a defekty v rozsahu teritorií odpovídajících magistrálním cévám mozku.
4.1.4. Detekce epileptického ložiska
Při medikamentosně nezvládnutelných parciálních fokálních epilepsií bývá někdy nutno detekovat ložisko spouštějící epileptické záchvaty, aby ho bylo možno chirurgicky odstranit.
Při iktálních vyšetření SPECT (99mTc-HMPAO, 99mTc-ECD) a PET (18F-FDG) je radiofarmakum injikováno na počátku záchvatu (pacient je EEG monitorován a sledován videokamerou). V tomto období je ložisko, které spouští záchvat, hyperaktivní a tomu odpovídá i příslušné zvýšení perfúze. Při aplikaci radiofarmaka na počátku záchvatu tedy dojde k jeho hyperakumulaci v ložisku, což lze prokázat scintigrafií, která se provádí až po odeznění záchvatu. Výše popsaný mechanismus akumulace a fixace perfúzních radiofarmak v ložisku totiž umožní „zakonzervování“ obrazu rozložení perfúze v mozkové tkáni z doby počátku záchvatu. Zobrazuje se hyperperfúze spouštěcího epileptického ložiska, tak jak je tomu ještě před generalizací záchvatu do ostatních struktur mozku.
Radionuklidová tomografická vyšetření v interiktálním období mohou zobrazit ložisko jako oblast hypoperfúze (SPECT) nebo hypometabolismu (PET). Senzitivita a specificita těchto vyšetření však není tak vysoká, jako je tomu u vyšetření iktálních.
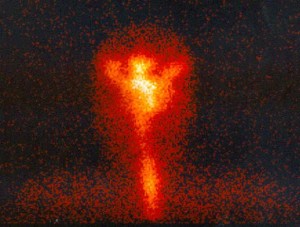
Obr. 11 Iktální 99mTc-HMPAO SPECT mozku u pacienta po operaci pro arachnoidální cystu okcipitálně vlevo – ložisko hyperperfúze při ventrokaudálním okraji léze (označeno šipkou).
4.2. Zobrazení mozkových receptorů a dopaminových transportérů – zobrazení dopaminového metabolismu v bazálních gangliích mozku
Scintigrafické zobrazení dopaminového metabolismu v bazálních gangliích napomáhá při diferenciální diagnostice extrapyramidových poruch hybnosti (schéma viz obr. 2).
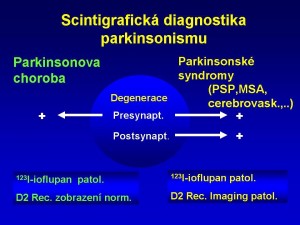
Idiopatická Parkinsonova choroba má příčinu v degeneraci nigrostriatálních drah, je při ní tedy postižena aferentní dráha vedoucí ze substanci nigra do bazálních ganglií (striata) (obr. 12).
Obr. 12. Idiopatická Parkinsonova porucha – alterace nigrostriatální dráhy.
Z toho vyplývá, že porucha v dopaminových synapsích je lokalizována ve striatu presynapticky (obr. 13). Při parkinsonských syndromech jiné degenerativní etiologie (MSA – multisystémová atrofie, PSP progresivní supranukleární obrna, atd.) nebo nedegenerativní etiologie (vaskulární parkinsonský syndrom) je alterováno přímo striatum (bazální ganglia), tzn., že porucha je lokalizována jak presynapticky, tak postsynapticky (obr. 13).
Obr. 13 Diferenciální diagnostika idiopatické Parkinsonovy choroba a parkinsonských syndromů jiné degenerativní nebo vaskulární etiologie.
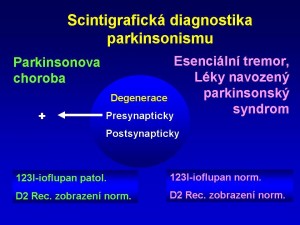
Při esenciálním tremoru a při parkinsonském syndromu vzniklém jako nežádoucí efekt jiné medikamentózní terapie není postižena žádná z částí dopaminové synapse (obr. 14).
Obr. 14 Diferenciální diagnostika idiopatické Parkinsonovy choroba a esenciálního tremoru.
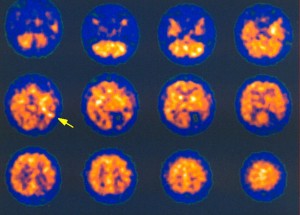
Z výše uvedeného vyplývá, že pomocí 123I-ioflupanu zobrazujícího presynapticky uložené dopaminové transportéry lze prokázat idiopatickou Parkinsonovu chorobu a tzv. Parkinson-plus syndromy. Hlavní význam takového tedy vyšetření spočívá v diferenciální diagnostice těchto chorob a esenciálního tremoru v komplikovaných případech a v ověření diagnózy Parkinsonovy choroby v jejích časných fázích. Deficit dopaminových transportérů je totiž velmi zřetelný již v počátečních fázích Parkinsonovy choroby, výrazné je především postižení putamen (změny v oblasti nc. caudatus navazují s časovým zpožděním) (obr. 15).
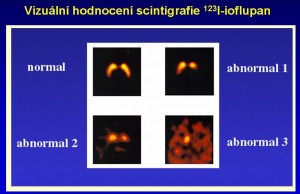
Obr. 15 Vizuální hodnocení nálezů 123I-ioflupan SPECT . Transverzální řezy bazálními ganglii s různým stupněm postižení: Stupeň I postižení – asymetrie hustoty dopaminových transportérů v putamen: normální nebo téměř normální hustota dopaminových transportérů v jedné hemisféře a výraznější redukce hustoty dopaminových transportérů v druhé hemisféře bez deficitu dopaminových transportérů v ncc. caudati; Stupeň II postižení – výrazné bilaterální snížení hustoty dopaminových transportérů v putamen, při neporušené hustotě dopaminových transporterů v ncc. caudati; Stupeň III postižení – téměř chybějící vychytávání radiofarmaka v putamen i v ncc. caudati.
Při posuzování stupně postižení se používá vizuální hodnocení se 3 stupni závažnosti postižení (nejdříve je poškozena oblast putamen, až s dalším vývojem dochází i k deficitu dopaminových transportérů v nc. caudatus) (obr. 15). K hodnocení lze využít i semikvantitativní hodnocení výpočtem indexu specifické aktivity ve striatu a jeho dvou částech (viz nahoře obr. 5).
123I-IBZM zobrazuje postsynapticky lokalizované D2 receptory, jejichž deficit prokazuje postsynaptické postižení. Tato scintigrafie tedy může přispět k odlišení idiopatické Parkinsonovy choroby (bez postsynaptické alterace) a chorob z Parkinson-plus okruhu (s přítomností postsynaptické alterace).
Nověji byl prokázáno, že pomocí 123I-ioflupanu lze diagnostikovat demenci s Lewyho tělísky, při které je také sníženo množství dopaminových transportérů.
Obr. 16 123I-ioflupan SPECT u pacienta s demencí s Lewyho tělísky
4.3. PET vyšetření mozku – vyšetření metabolismu CNS a detekce tumorů a jejich reziduí v mozkové tkáni
PET vyšetření mozku lze použít:
- K detekci tumorů mozku a jejich reziduální tkáně.
- K posouzení metabolické aktivity mozkové tkáně v závislosti na funkční aktivitě mozkové tkáně.
- K hodnocení rozložení receptorů v mozkové tkáni.
4.3.1 Detekce tumorů mozku pomocí PET a SPECT
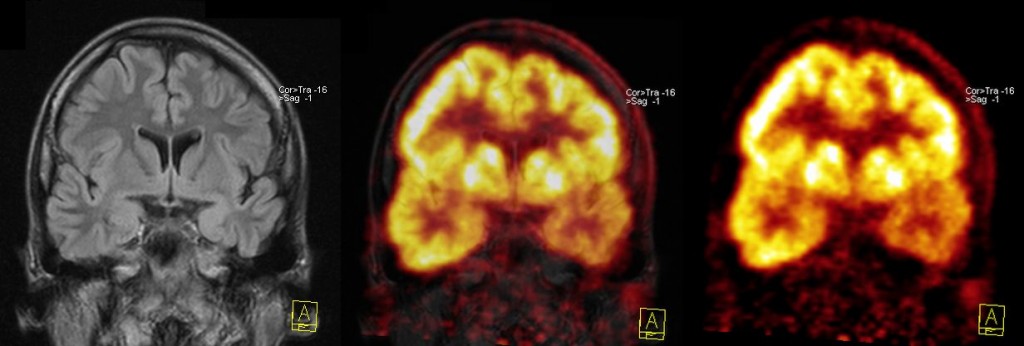
Akumulace 18F-FDG v mozkových gliomech závisí na míře malignity těchto tumorů – zvýšená akumulace radiofarmaka je typická jen pro high-grade gliomy (grade III a IV). Tuto skutečnost lze teoreticky využít pro neinvazivní grading tumorů. Za hlavní indikací 18F-FDG PET je ale považován průkaz reziduální viabilní tkáně high-grade gliomů a metastáz po operaci nebo v místech změněných jinou terapií (zevní ozáření) (obr. 16). Významné je především odlišení viabilní tumorózní tkáně od poterapeutických ložiskových změn. Vyšetření je přínosné především při indikaci terapie zevním ozářením pomocí tzv. „gama nože“. Určitým problémem v hodnocení reziduální nádorové tkáně je fakt, že šedá hmota mozková sama o sobě velmi intenzivně vychytává 18F-FDG, a proto někdy bývá obtížné odlišit akumulaci 18F-FDG v tumoru a šedé hmotě.
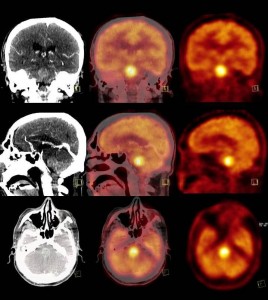
Obr. 17 18F-FDG PET/CT. Mozková metastáza. 18F-FDG PET u pacienta s mozkovou metastázou Grawitzova tumoru v pons Varoli – fúze PET/CT. Vybrané tomografické řezy mozkem jsou součástí PET/CT vyšetření trupu a hlavy, kvalita PET obrazů odpovídá akvizičním parametrům, které jsou jiné než při cíleném PET vyšetření mozku.
S výhodou lze využít radiofarmaka akumulující se v maligní tkání a přitom nevychytávající se šedé hmotě mozkové. Jde především o radiofarmaka zobrazující proliferační aktivitu nebo proteosyntézu. K zobrazení proliferační aktivity slouží nukleosid thymidin značený například 18F (18F-FLT) (obr. 17). K zobrazení proteosyntézy lze například využít tyrosin značený 18F (18F-alfa-methyl-tyrosin pro PET). Pro SPECT vyšetření lze analogicky využít 123I (123I-tyrosin).
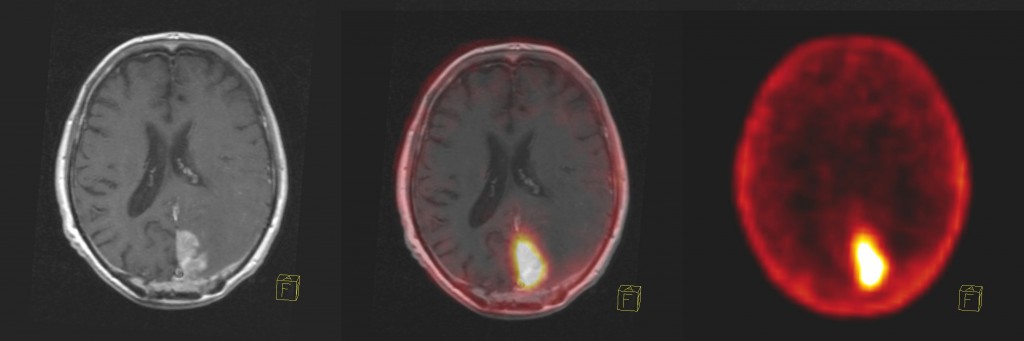
Obr. 18 18F-FLT PET – fúze s MR u pacienta s mozkovou metastázou bronchogenního karcinomu. MR – T1 vážený obraz: Okcipitálně vlevo je zřejmé hyperintenzivní ložisko velikosti 4×2,8×2,1 cm, ložisko se po aplikaci kontrastní látky sytí mírně nehomogenně, výrazněji se sytí lem ložiska. 18F-FLT PET prokazuje zvýšenou akumulaci radiofarmaka v ložisku, která svědčí pro přítomnost viabilní nádorové tkáně s vysokou proliferační aktivitou.
Meningeomy a jejich případné recidivy se vyznačují výraznou expresí somatostatinových receptorů, proto je lze zobrazit velmi dobře pomocí scintigrafie po podání 111In-pentetreotidu (preparát Octreoscan), který je analogem somatostatinu.
Obr. 19 111In-pentetreotid SPECT mozku – meningeom. 111In-pentetreotid SPECT mozku u pacienta s meningeomem v blízkosti sella turcica. Nutná dif. dg.: Vyšší akumulace radiofarmaka se objevuje i u některých tumorů hypofýzy.
4.3.2 Metabolismus glukózy jako ukazatzel funkční aktivity mozkové tkáně mozkové tkáně a její perfúze
V současné době lze i v rutinní praxi použít PET vyšetření k hodnocení funkční aktivity mozkové tkáně a intenzity perfúze. PET vyšetření po podání 18F-FDG, které poskytuje informaci o míře utilizace glukózy v jednotlivých strukturách mozku, může být použito při obdobných indikacích, které platí pro perfúzní scintigrafii mozku (diferenciální diagnostika demencí, detekce epileptického fokusu, aktivační studie v psychiatrii). Výhodou PET je detailnější rozlišení jednotlivých struktur mozku, nevýhodou je významně vyšší cena vyšetření. Limitací pro detekci epileptického fokusu je také velmi krátký poločas 18F, který komplikuje iktální provedení vyšetření (během krátkého vymezeného času na vyšetření nemusí dojít k epileptickému záchvatu a vyšetřením pak lze zobrazit pouze klidové rozložení metabolismu mozku).
Obr. 20 Interiktální 18F-FDG PET mozku u pacientky s epilepsií – hypometabolismus glukózy temporopolárně vlevo při nevýrazné hippokampální asymetrii na MR – fúze 18F-FDG PET/MR – koronární řezy.
4.3.3. PET detekce receptorů v mozkové tkáni
V budoucnu lze očekávat, že PET pomocí nových radiofarmak umožní přesněji hodnotit distribuci různých receptorů v mozku.
4.4. Radionuklidová likvorografie – zobrazení toku mozkomíšního moku
Mozkomíšní mok se vytváří v chorioidálních plexech postranních komor a následně odtéká z postranních komor do III. a následně IV. komory, z níž dále pokračuje v toku do cisterna magna a bazálních cisteren. Z cisteren vede tok moku do subarachnoideálních prostorů míchy a mozku, k jeho vstřebávání dochází v arachnoideálních granulacích především v oblasti sinus sagitalis superior.
Při radionuklidové cisternografii je 111In-DTPA podána sterilní lumbální punkcí do subarachnoideálního prostoru. Následně radiofarmakum difunduje subarachnoideálním prostorem míchy a za normálních okolností dosáhne za 1 hodinu od aplikace úrovně bazálních cisteren, za 2 – 6 hodin frontálních laloků a sylvijské rýhy, za 12 hodin konvexit mozkových a za 24 sagitálních sinů. Vzhledem k tomu, že mozkomíšní mok se vytváří v postranních komorách a odtud teče do oblasti bazálních cisteren, je zřejmé, že za normálních okolností nemůže dojít k průniku radiofarmaka do postranních komor.
Z výše uvedeného vyplývá i způsob vyšetření. Tok radiofarmaka je sledován sérií statických scintigramů v zadní, přední a bočných projekcích v průběhu 24 až 48 hodin od aplikace radiofarmaka.
Vyšetření slouží k diagnostice likvorey, diagnostice normotenzního komunikujícího hydrocefalu, případně k ověření průchodnosti shuntu odvádějícího likvor, který byl založen k terapii obstrukčního hydrocefalu.
4.4.1. Diagnostika likvorhey
Při diagnostice likvorey se v době, kdy radiofarmakum přiteče k podezřelému místu, zatamponuje oblast podezřelá z likvorey (nos nebo ucho). Následně se scintigrafií pátrá po průniku radiofarmaka do tamponu. Poté se stanoví měrná aktivita tekutiny absorbované v tamponu a srovná se s měrnou aktivitou krevní plasmy v příslušném období. Signifikantně vyšší četnost aktivity radiofarmaka v tekutině z tamponu je pak průkazem likvorey. Je nutno mít na zřeteli, že laboratorní měření radioaktivity tamponu je citlivější k průkazu likvorey než pouhá scintigrafie, která je průkazná jen při masivní likvororee.
Obr. 21 111In-DTPA cisternografie s aplikací radiofarmaka lumbální punkcí při diagnostice likvorey (otorey). Na scintigramu v zadní projekci za 10 hodin od aplikace je zřejmý odtok radiofarmaka pravým uchem.
4.4.2. Průkaz komunikujícího hydrocefalu
Typickým nálezem při komunikujícím hydrocefalu (tj. hydrocefalu vzniklém při extrakomorové blokádě toku likvoru nebo při poruše jeho resorpce v arachnoideálních granulacích, která je relativně častou komplikací po subarachnoideálním krvácení) je průnik radiofarmaka do postranních komor. Jde tedy o průnik radiofarmaka proti směru zvyklého toku mozkomíšního moku.
Obr. 22 111In-DTPA cisternografie – komunikující normotenzní hydrocefalus. Scintigramy v přední (obr. 22a; vlevo)) a zadní (obr. 22b; vpravo) projekci 24 hodin od aplikace prokazují průnik radiofarmaka do postranních komor.
4.4.3. Ověření průchodnosti ventrikulárních shuntů
Při průchodném shuntu odvádějícím likvor z postranních komor při obstruktivním hydrocefalu je scintigraficky zřetelné zobrazení shuntu naplněného likvorem s radiofarmakem.
Zpracoval: Doc. MUDr. Pavel Koranda, Ph.D., Klinika nukleární medicíny LF UP a FN v Olomouci.