Úvod
Definice přijatá Světovou asociací pro studium bolesti (International Association for Study of Pain, IASP; http odkaz – klikněte zde) uvádí:
- Bolest je nepříjemný smyslový a emoční zážitek, spojený se skutečným nebo potenciálním poškozením tkání, nebo popisovaný výrazy pro takové poškození. Bolest je vždy subjektivní.
Bolestivý zážitek má tyto vlastnosti:
- Existence vlastní tkáňové léze;
- Uvědomění si bolestivého vstupu do mozku;
- Zhodnocení situace pomocí analýzy zrakových, sluchových či jiných smyslových počitků;
- Porovnání záznamu s podobným paměťovým záznamem bolesti;
- Analýza poškození v kontextu se vzpomínkami a odraz současné nálady – ovliněno zkušeností, očekáváním, překvapením;
- Porovnání sekundární fyzické odpovědi s celým zážitkem – proces učení vede k vyhýbání se vyvolávající škodlivině, nebo schopnosti bolest snášet.
Bolestivý zážitek je zprostředkován aferentním nervovým systémem a mozkovou kůrou a má významnou emoční složku. Informuje tedy o skutečném či možném poškození organismu, účastní se vytváření paměťových stop (motivační faktor). Její lokalizace a charakteristika někdy umožňuje stanovit druh nemoci, eventuálně její prognózu. Je nejčastějším důvodem, proč nemocný vyhledá lékařské ošetření.
Studium anatomie drah, fyziologie, patofyziologie, klinických projevů v jednotlivých orgánech a aspektů terapie bolesti probíhají neustále.
Periferní struktury nervového systému participují a vedou bolest do centrálních struktur – tam je bolest zpracována, modulována a vytváří se reakce na ni.
Dráha bolesti
Vznik a přenos signálu bolesti a vnímání bolesti (nocicepce) jsou neurohumorální procesy zahrnující podráždění nociceptorů, převod podráždění aferentními nervovými vlákny do mozku a následné zpracování podráždění centrálním nervovým systémem.
Dráha bolesti je tříneuronová. Má četná propojení do různých oblastí mozku. Proto jsou bolestivé podněty spojeny s nepříjemnými pocity, aktivací sympatiku, parasympatiku, s motorickou reakcí. Bolest představuje signál nebezpečí, který provází anebo po kterém múže následovat poškození tkáně. Vnímání bolesti může napomoci k lokalizaci chorobného procesu.
Bolest je výsledkem zpracování bolestivého podnětu v centrálním nervovém systému, tedy bolestivý vjem jako subjektivní pocit. Konečný vjem bolesti je vždy závislý na zpracování v CNS, a ne pouze na charakteru původního podnětu. Na centrální i periferní úrovni současně existují mechanismy, které bolest kontrolují a modifikují ji – tlumí, nebo zesilují. Od vnímání bolesti nelze oddělit subjektivní složku vnímání bolesti (u každého člověka může být jiná). Také nelze přesně oddělit kognitivní a emocionální složku bolesti, což jsou děje probíhající na úrovni centrálního nervového systému. Bolest také nelze oddělit od reakcí doprovázejících stres.
Soustava vnímání bolesti není součástí somatosenzorického systému, i když probíhá společně s jeho drahami. Vnímání bolesti zprostředkuje samostatný smyslový (senzorický) nocicepční systém (nocicepce).
O samostatnosti systému vnímání bolesti svědčí i syndrom vrozené ztráty bolesti - ostatní somatosensorické mechanismy jsou zachovány, ale vnímání bolesti je porušeno. Bolest tedy je samostatná nosologická jednotka.
Receptory bolesti
- Primárními receptory pro senzorické vnímání bolesti (nocicepci) jsou nociceptory. S největší pravděpodobností jde o volná, nekorpuskulární nervová zakončení aferentních vláken.
- Nociceptory jsou pro bolest specifické a nereagují na žádnou jinou modalitu. Aktivují se pouze při bolestivé stimulaci. Reagují na chemické (biochemické) podněty. Většinou jsou v klidu – mlčí (tzn. tiché, spící, silent receptors). Nociceptory jsou uloženy na periférii v kůži, ve sliznicích, ve svalech a kloubech (tam s různou hustotou) a ve všech ostatních tkáních těla, jsou přítomny i ve vyšších částech nervové soustavy, v míše, prodloužené míše, kmeni mozkovém, talamu, kůře mozkové. Jsou lokalizována zejména v adventicii malých cév a v lymfatických cévách, dále v lumen cév a event. v pojivové tkáni. Překvapivě se nacházejí i v endoneuriu.
- Druhou a třetí skupinu nociceptorů – nocisenzorů – tvoří nespecifické receptory, které jsou původně určeny pro reakci na jiné modality, ale za určitých okolností reagují na bolestivé podněty. Podle reakce na bolestivé podněty a podle způsobu vedení bolestivých vzruchů se dále dělí na polymodální nociceptory a mechanosenzory.
- Polymodální nociceptory reagují na více modalit, především však na teplo a chlad. V normálním rozsahu teplot reagují na tepelné změny Ruffiniho tělíska (především na zvýšení teploty) a Krauzeho tělíska (na snížení teploty). Na tepelné změny ale mohou reagovat i další typy receptorů. Když ovšem tepelná změna (chlad nebo zvýšení teploty) překročí fyziologickou hranici, jsou intezívní signály z těchto receptorů vnímány bolestivě. Tento systém je tvořen nemyelinizovanými C vlákny o průměru 0,4 –1,2 µm. Vlákna C jsou uložena v laterální části zadních kořenů míšních. Vedou vzruchy nízkou rychlostí 0,5 – 2 m/s.
- Mechanosenzory (mechanoreceptory) reagují převážně na mechanická podráždění (tah, tlak, vibrace). Při zvýšené intenzitě stimulace signalizují působící podněty jako bolest. Práh dráždění mechanoreceptorů je individuálně velmi variabilní, jsou to vysokoprahové mechanosenzory. Většinou jde o Vater-Paciniho tělíska. Tento nocicepční systém je tvořen tenkými myelinizovanými vlákny A∂ o průměru 2 – 5 µm, která vedou rychlostí 12 – 30 m/s.
- Obě právě popsané skupiny vláken končí v zadních rozích míšních. C-vlákna končí ve vrstvě I a II, zatímco vlákna A∂ primárně končí na neuronech vrstev I a V. Je prokázáno, že synaptickým přenašečem uvolňovaným primárními aferentními vlákny vedoucími bolest je substance P.
Shrnutí: Typy nocisenzorů:
- Volná nervová zakončení (bouton terminal);
- K převodu signálu bolesti využívají Na+,K+-kanály.
- Polymodální nocisenzory. Jsou citlivé na bolest, teplo, chlad, mechanické dráždění. Vzruchy se šíří vlákny typu C.
- Vysokoprahové mechanosenzory. Jsou citlivé na silné mechanické podněty (tlak, tah, vibraci). Vzruchy se vedou vlákny A∂.
Prahy vnímání u nocisenzorů:
- Existují nocisenzory specifické pouze po bolest (syndrom ztráty vnímání bolesti při zachování senzorické percepce!).
- Existují tiché (silent) nocisenzory.
- Nocisenzory mají schopnost měnit svůj práh; mají schopnost senzitizace (snížení prahu pro podráždění bolestivými podněty) a je možná i desenzitizace receptorů (zvýšení prahu pro podráždění bolestivými podněty); na těchto jevech se však často podílejí i cetnrální mechanismy (viz např. stresová analgézie).
Způsob dráždění nocisenzorů. Mediátory bolesti.
- Nocisenzory mohou být drážděny mechanicky (štípáním, pícháním), termicky (teplem, chladem) a chemicky (různými látkami, z nichž nejvýznamnější jsou bradykinin a prostaglandiny; viz níže). Multimodální receptory také mohou být drážděny různými způsoby. Nocisenzory mohou být drážděny přímou stimulací draselnými ionty. Zvýšení jejich koncentrace v tělesných tekutinách, zejména v extracelulárním prostoru v okolí receptorů, přímo dráždí nocisenzory.
- Při silném podráždění (např. při traumatu) se uvolňují látky, které chemicky dráždí nociceptory. Spektrum těchto látek je velmi podobné těm, které se uvolňují při zánětu. Je známo, že většina zánětlivých procesů je provázena intenzivní bolestí.
- Zejména se uvolňují následující mediátory: Kyselina arachidonová, ionty draslíku a vodíku, některé kininy, zejména bradykinin (uvolňuje kalium z poškozených buněk), prostaglandiny (především prostaglandin E), histamin, serotonin (5-hydroxy-tryptamin), vazointestinální peptid (VIP), enkefaliny, fosfolipidy, interleukin a ATP, dále peptid odvozený z genu kalcitoninu (calcitonin gene related peptid). V nociceptorech je také velmi aktivní kanál sodných iontů. Při podráždění je rovněž uvolňována substance P, která vyvolává vazodilataci a zvyšuje permeabilitu cév, a tím způsobí edém (také jedna ze známek zánětu), především v periférii. Na úrovni míchy je substance P excitačním mediátorem. Je aktivní především v I. a II. míšní Rexedově zóně. Při mechanickém dráždění (které provází každé trauma) se uvolňují látky i z krevních destiček, zejména serotonin.
- Po působení výše uvedených mediátorů dojde k první reakci – tj. podráždění nociceptorů.
- Na úrovni kanálů (kanály jsou na volných zakončeních nervových i na dalších receptorech, ať už na mechanoreceptorech nebo na polymodálních receptorech) jsou nejdůležitější kanály iontů sodíku. Selektivním blokátorem kanálů sodných iontů je tetrodotoxin – látka pocházející z ryby Tetrodos. Dnes je známo 5 kanálů pro ionty sodíku, z nichž 3 jsou tetrodotoxin-senzitivní a 2 tetrodotoxin-rezistentní. Pro transmisi bolesti mají největší význam tetrodotoxin-rezistentní kanály. Experimentálně se už používají k léčení bolesti některé blokátory kanálů sodných iontů. Kanály iontů sodíku blokují i lokální anestetika.
- Další kanály o kterých je známo, že participují na bolesti, jsou ASIC – acid sensing ion channels. Tyto kanály reagují na změnu pH, která velmi ovlivňuje vnímání bolesti. Jestliže se acidifikuje tkáň, pak snížené pH dráždí především volná nervová zakončení (acidóza ve tkáních způsobuje bolest při zvýšené hladině kyseliny mléčné, která vzniká při svalové únavě v kosterních svalech a vzniká bolest). Blokátory ASIC se již používají ke snížení vnímání bolesti.
- Pro přenos bolesti je také důležitá ATP, která se váže na purinergní receptory P2X, a stává se mediátorem bolesti.
- Kapsaicinový (vanniloidní) receptor reaguje na různé podněty. Samotný kapsaicin pak může mít dvojí účinek: Na jedné straně může bolest provokovat, ale na druhé straně ji může i tlumit účinkem.
Postup aktivace algoreceptorů s účastí eikosanoidů je následující:
- Poškození tkáně → Poškození buněčných membrán a aktivace fosfolipázy A2.
- V mistě poškození vzniká zánětlivá reakce s hyperémií, uvolňují se histamin a bradykinin, substance P.
- Také se uvolňuje kyselina arachidonová
- Prostřednictvím cyklooxygenázy vzniká prostaglandin E2 (PGE2) → to vede k zesílení účinku mediátorů na algoreceptory;
- PGE2 je sekundární potenciátor, snižuje práh citlivosti mechanoreceptorů a nocisenzorů vůči periferním mediátorům a induktorům bolesti (analoga typu aspirinu a nesteroidní antiflogistika tlumí cyklooxygenázu);
- Leukotrieny vznikají z kyseliny arachidonové prostřednictvím 5-lipooxygenázy → pak rovněž senzibilizují aferentní nociceptivní vlákna → nociceptory reagují na opakované podněty zvyšující se frekvencí výbojů.
- Prostřednictvím cyklooxygenázy vzniká prostaglandin E2 (PGE2) → to vede k zesílení účinku mediátorů na algoreceptory;
- Důležitými příspěvky ke znalostem o nocicepci na receptorové úrovni byly:
- Průkaz subtypů B1- a B2- receptorů pro bradykinin;
- Objev receptoru NK1 receptorů pro substanci P;
- Objev receptoru NK2 pro neurokinin A;
- Objev NMDA ( N- metyl-D-aspartátových) receptorů pro excitačně působící neurotransmittery. NMDA receptory se podílejí na rozvoji centrální senzitizace, proto se hledají jejich antagonisté.
- V primárních aferentních neuronech vedoucích informaci o bolestivém podnětu mají velmi významnou úlohu napěťově závislé kanály sodných iontů, které mohou být ovlivňovány jak endogenně (např. endotrofními faktory), tak i farmaky. Na bolesti spojené s tepelnými podněty se také podílí už výše zmíněný vanniloidní (kapsaicinový) receptor.
- Na úrovni zakončení senzitivních vláken i na vyšších úrovních v centrálním nervovém systému (CNS) ovlivňuje práh nocicepce ionizované kalcium, na něž je možné působit látkami z různých lékových skupin. Zvýšení intracelulárního kalcia bylo pozorováno po prostaglandinu E2, po bradykininu a po aktivaci NMDA receptorů.
Senzitizace a desenzitizace receptorů bolesti a vnímání bolesti
Významnou vlastností nociceptorů je také to, že mohou měnit svůj práh, takže je možno mluvit o senzitizaci a desenzitizaci.
Nociceptory ve zdravé tkáni mají širokou škálu prahů na bolestivé stimuly. Nemohou být excitovány jinak, než opravdu bolestivým podnětem. Je-li tkáň bolestivě stimulována a je-li naví c patologicky alternována (např. při zánětu), pak jsou nociceptory senzitizovány a jejich práh se podstatně snižuje. Znamená to, že tiché neboli spící (silent) spící nociceptory se rázem probudí a začnou reagovat. Senzitizace je vyvolána výše uvedenými algickými látkami.
Jestliže dojde k senzitizaci, vzniká hyperestézie, tj. zvýšená citlivost. Tak je tomu v místech lokálního zánětu. Nociceptory se pak mohou samy vybudit k činnosti a vzniká tzv. neurogenní zánět. Látky, které se z tohoto místa uvolňují, jakož i zmíněná substance P, ale i CGRP (calcitonin gene related peptide) a další, způsobují vazodilataci a změny permeability, a tím i vznik lokálního edému. Substance P současně vyvolá také imunitní reakce a poruchu trofických funkcí. Histamin, který se uvolňuje z žírných buněk, vede k senzibilizaci, tzn. že zapojuje další nociceptory do činnosti, zesílí vazodilataci, a hyperestézie se potom v postižené oblasti zvyšuje.
Při bolesti se tlumí některé inhibiční mechanismy, především systém GABA. Proto na bolest působí i látky typu gabapentinu (původně antiepileptikum); výrazně tlumí vnímání bolesti.
NMDA receptory se podílejí na rozvoji centrální senzitizace. Proto se hledají se jejich antagonisté. Byla objasněna i role oxidu dusnatého, který se mimo jiné podílí i na rozvoji hyperalgézie. U nádorových bolestí se na aktivaci nociceptorů a rozvoji bolesti podílí i endotelin-1.
Vedle senzitizace nociceptorů je známá i jejich desenzitizace. Změny prahu bolestivosti mohou vyvolat i některé látky s periferním účinkem. Může se měnit práh citlivosti nociceptorů; snížení prahu pro podráždění bolestivými podněty je senzitizace, je možná i desenzitizace receptorů (zvýšení prahu pro podráždění bolestivými podněty); na těchto jevech se však často podílejí i cetnrální mechanismy (viz např. stresová analgézie).
Vedení bolestivého podnětu z nociceptorů do míchy
Bolestivé vzruchy jsou přenášeny do centrálního nervového systému dvěma systémy vláken:
- První systém se skládá z nemyelinizovaných C-vláken o průměru 0,4 – 1,2 µm. Tato vlákna jsou v laterální části zadních kořenů a jsou často nazývána C-vlákna zadních kořenů. Vedou nízkou rychlostí 0,5 – 2 m/s.
- Druhý nocicepční systém je tvořen malými myelinizovanými A∂ vlákny o průměru 2 - 5 µm, které vedou rychlostí 12 – 30 m/s.
Podle různých typů bolestivých podnětů vede bolestivé impulzy převážně jedna nebo druhá skupina vláken. Na rychlost vedení v těchto vláknech působí různé látky, např. volné mastné kyseliny, oxid dusnatý (NO), ale také NMDA ( N-metyl-D-aspartát). Ke svému postnatálnímu růstu tato vlákna potřebují nervový růstový faktor (NGF).
C-vlákna zadních kořenů zadních kořenů končí ve vrstvě I a II, zatímco A∂ vlákna vlákna primárně končí na neuronech vrstvy I a V zadních míšních rohů. Synaptickým přenašečem uvolňovaným primárními aferentními vlákny vedoucími bolest je substance P.
Vedení bolestivých vzruchů z míchy do vyšších struktur centrálního nervového systému
- První neuron (tříneuronové) dráhy bolesti je pseudo unipolární buňka (T-buňka) spinálního ganglia. Vede podnět od nociceptoru (receptoru pro bolest).
- Nocicepční vlákna prvního neuronu vstupují do zadních rohů míšních, kde vystupují, nebo sestupují o několik segmentů výše, nebo níže, a vytvářejí synapse s neurony zadních rohů míšních. Vzruchy odtud mohou být rychle převedeny na α-motoneurony v předních rozích míšních, což zabezpečuje reflexní motorickou odpověď na bolestivý podnět. Na míšní úrovni je transmise bolestivé informace nejlépe prostudována, mediátorem je substance P.
- Z míchy jsou bolestivé vzruchy vedeny do vyšších etáží nervového systému spinotalamickými drahami, a to buď laterální spinotalamickou drahou, nebo spinoretikulotalamickou drahou. Druhý neuron dráhy bolesti je uložen v zadních rozích míšních (Rexedovy zóny 1 až 10) (Obrázek: http://img.mf.cz/906/697/204.jpg). V Rexedových zónách už existuje určitá distribuce podle typu bolesti. Povrchní, akutní bolest prochází povrchními Rexedovými zónami v substantia gelatinosa Rolandi (zóny 1 a 2). Spolu s třetí vrstvou se celá tato struktura nazývá nucleus proprius. Bolest hluboká – viscerálního typu – se převážně projikuje do hlubších vrstev 5, 8 a 10. Proto také lze na míšní úrovni dělat určitou diferenci mezi percepcí povrchní, kožní bolesti a hluboké, viscerální bolesti. Z Rexedových zón je bolest vedena Lissauerovým traktem a z něj do spinotalamických drah. Substance P v tomto přenosu slouží jako druhý periferní nociceptivní senzibilizátor (mediátor).
-
- Substantia gelatinosa Rolandi je inhibičně působící oblast oblast v zadních rozích míšních. Mediátorem je enkefalin. Oblast zadních rohů je dále tlumena z CNS (tr. reticulospinalis).
- Některé axony neuronů zadních kořenů končí v míše a v mozkovém kmeni. Jen málo vláken stoupá v posterolaterální části míchy. Ostatní vstupují do anterolaterálního systému včetně laterálního spinotalamického traktu (obrázek: http://img.mf.cz/911/697/206.jpg).
- Tractus spinotalamicus slouží pro rychlý přenos vzruchu do ventrální posterolaterální části talamu. Tato dráha vede povrchní bolest z Rexedových zón 1, 2 a 3 do laterálního talamu (do ventrobazálního komplexu talamu, VB). Ten je složen ze dvou jader, pro projekci z těla je určen nucleus ventoposterolateralis (VPL), z oblasti obličeje pak nc. ventroposteromedialis (VPM). Tyto dráhy představují přímé spojení mezi míchou a talamem. Při stimulaci také mají nejkratší latenci. Touto rychlou dráhou se přenáší pronikavá, bodavá bolest (obrázek: http://img.mf.cz/911/697/206.jpg).
- Tractus spinoreticulotalamicus vede bolest viscerální (hlubokou). Vede ji přes retikulární formaci mozkového kmene do limbického systému a přes něj do mediálních intralaminárních jader talamu – centrum medianum (CM), nucleus centralis lateralis (CL) a nucleus parafascikularis (pF) talamu. Do těchto oblastí se projikují převážně axony začínající v Rexedových zónách V a VIII. Vlákna spinoretikulotalamické dráhy končí také v hypotalamu, kde byly rovněž nalezeny nociceptory a nocicepční vlákna (obrázek: http://img.mf.cz/911/697/206.jpg).
- K těmto drahám se někdy přidružují informace spinobulbární dráhy - dráhy zadních provazců míšních, kudy se (jak se v poslední době ukazuje) také mohou vést bolestivé informace, zejména z hlubokých struktur, a to především ze tkání poskytujících informace proprioceptivní (svaly, šlachy, klouby) (obrázek: http://img.mf.cz/911/697/206.jpg).
- Předpokládá se, že vlákna A∂, která vedou hlavně rychlou a ostrou bolest, končí v jádrech ventrobazálního talamu (VB), zatímco vlákna C, která vedou déletrvající a tupou bolest, končí v intralaminárních jádrech talamu. Vedení ostré bolesti z hlavy a obličeje se děje vlákny n. trigeminus , která jdou do talamu cestou laterálních a trigeminálních lemnisků a končící ve ventrobazálním jádře talamu (VB) (obrázek: http://img.mf.cz/911/697/206.jpg).
- Třetí neuron, resp. čtvrtý neuron zajišťuje přepojení vzruchů v talamu, odkud informace jdou do somatosenzorické kůry asociačních korových oblastí (obrázek: http://img.mf.cz/911/697/206.jpg). Bolest aktivuje 3 korové oblasti: SI, SII a gyrus cingularis na kontralaterální straně bolestivého podráždění. Gyrus cingularis se účastní emočních reakcí: cingulární gyrektomie zmenší utrpení, které provází chronickou bolest.
- Po zpracování informací z periférie se uskutečňuje náležitá odpověď. Centrální řízení umožňuje modifikaci bolesti.
Centrální lokalizace bolesti
Systém retikulární formace vede impulzy do hypotalamu a limbického systému, který ovlivňuje především emotivní složku bolesti. Retikulární systém má spoje i s jádrem locus coeruleus, které se významně účastní na modulaci bolesti a které má přímý vztah k reakcím strachu a úniku. Je odpovědné za to, že před bolestí unikáme.
V samotném talamu, ve ventrobazálním komplexu, je bolest přesně somatotopicky lokalizována. Neurony v mediálním talamu nejsou tak specificky organizovány.
Vlákna z obou skupin talamických jader pak vstupují do mozkové kůry a také do limbického systému, který reguluje emoce a paměť. Vlákna z VB ( VPL a VPM) vedou do oblasti mozkové kůry zvané gyrus postcentralis.
Vlákna z intralaminárních jader vedou do gyrus cinguli a do premotorické oblasti (obrázek: http://img.mf.cz/911/697/206.jpg). Zvláštní pozornost vzbuzuje to, že elektrická stimulace VPL nevyvolává bolestivé fenomény, kdežto stimulace intralaminárních jader talamu bolest vyvolá. Je ale prokázána komunikace těchto dvou skupin jader mezi sebou – je nepřímá a děje se prostřednictvím nc. reticularis talami. Jádra obou skupin mají velmi intenzivní spoje. Existují také četné spoje do bazálních ganglií.
V mozkové kůře v oblasti gyrus postcentralis je lokalizována ostrá přímá bolest, zatímco bolest tupá a především viscerální je lokalizována spíše v mimofrontálních oblastech, a to konkrétně v gyrus cinguli.
Podkorové vnímání a citová (afektivní) složka
Existuje dostatečné množství důkazů o tom, že senzorické podněty jsou vnímány i po odstranění mozkové kůry. Platí to zvláště pro bolest. Korové percepční oblasti mají zřejmě za úkol přesnou analýzu druhu, rozlišení a významu bolesti a některých jejích emočních složek, zatímco pro vlastní percepci bolesti zapotřebí nejsou. C. S. Sherington nazval bolest „fyzickým doplňkem imperativního ochranného reflexu“. Podněty působící bolest zpravidla vyvolávají významné reakce ve smyslu úniku a vzdálení ohrožených částí těla od nocicepčního podnětu.
Další zvláštností odlišující bolest od ostatních počitků je její doprovodná silná emoční (citová) složka. Informace zprostředkované speciálními smysly mohou druhotně vyvolat příjemné, nebo nepříjemné emoce, které převážně vycházejí z předchozích zkušeností. Bolest jako jediná však má v sobě pevně zabudovaný, nepříjemný pocit.
Tato citová odpověď zčásti závisí na cingulární a frontální části mozkové kůry, ale z podkorových struktur se na ní podílí i talamus. Poškození talamu může být spojeno se zvláštní hyperreaktivitou na bolestivé podněty, známou jako talamický syndrom. Za těchto podmínek, způsobených obvykle uzávěrem talamogenikulární větve arteria cerebri posterior a následným poškozením zadních talamických jader, vyvolají již slabé podněty dlouhotrvající, silnou a krutou bolest. Takovéto záchvaty mohou vznikat i spontánně, nebo alespoň bez patrnějších vnějších podnětů.
Bolest je samostatný fenomén. Svědčí o tom i to, že existuje syndrom vrozené necitlivosti k bolesti. Při tomto syndromu je poškozeno pouze vnímání bolesti, zatímco ostatní modality jsou nedotčeny.
Descendentní dráhy systému vnímání bolesti
Kromě ascendentních drah vedení bolesti existují i dráhy descendentní. Podle současných znalostí začínají především v periakveduktální šedi (PAG) a v rafeálních jádrech (nc. raphe magnus a nc. raphe dorsalis). V těchto místech je největší produkce endorfinů a dynorfinů.
Dalšími látkami, které ovlivňují bolest, jsou estrogeny, které blokují aktivitu NMDA receptorů v míše. NMDA receptory facilitují přenos bolestivého vzruchu míchou. Hladina endorfinů a enkefalinů a vliv estrogenů vysvětlují rozdílnou reakci na bolest u mužů a u žen (resp. u samců a samic). U žen je vyšší hladina estrogenů, ale také vyšší hladina endorfinů, zejména v období před porodem a po něm, a dále kolísá během menstruačního cyklu. To vysvětluje, proč ženy, které obecně mají nižší práh bolesti, se přesto s bolestí lépe vyrovnávají než muži.
Patofyziologická klasifikace bolesti
Existují různé druhy bolesti:
- Nociceptivní (nociceptorová, nocisenzorická);
- Neurogenní;
- Dysautonomní;
- Psychogenní;
- Nespecifikovatelná.
Rozlišujeme 4 složky vnímání bolesti:
- Senzoricko-diskriminační.
- Afektivně emocionální.
- Vegetativní (autonomní).
- Motorická.
Dělení bolestivých stavů podle průběhu
Z hlediska doby trvání a přístupu k léčbě je účelné rozlišovat bolest akutní a chronickou. Pro bolest platí, že v centrálních částech je určitá algeziotopografie. Akutní bolest se vede do laterálních talamických jader (do ventrobazálního komplexu, VB, tj. do nc. ventroposterolateralis, VPL, a ventroposteromedialis, VPM) a odtud do gyrus postcentralis – Brodmanových areí 3,1,2.
Akutní bolest
Akutní bolest je symptom, který intenzivně informuje organismus o tkáňovém poškození. Dostavuje se okamžitě po po bolestivém podnětu a je to většinou bolest pálivá, ostrá. Jde především o bolest kožní, svalovou a kloubní. Přinutí pacienta vyhledat lékaře v průběhu minut až dnů po svém vzniku. Mezi akutní bolesti je možné zařadit i chronicky se opakující akutní záchvaty bolesti anebo některé druhy kolikovité bolesti, které mají silnou sympatickou složku. Sympatický nervový systém se účastní na projekci bolesti a hraje velmi důležitou úlohu především na úrovni míšní, ale může se uplatnit i na vyšších úrovních.
Charakteristika akutní bolesti
- Trvá sekundy až týdny, maximálně do 3 měsíců.
- Vzniká úrazovým mechanismem, operačním výkonem, chorobou.
- Působí jako silný stresor a vyvolá vyplavení katecholaminů, stresových hormonů, katabolismus a pokles imunity.
- Je doprovázena vegetativními příznaky, jako jsou tachykardie, tachypnoe, mydriáza, pocení, retence moči, zpomalení peristaltiky a hyperglykémie.
- Řídí se sympatickým vzorcem - fight or flight - anxieta – vyhledání pomoci.
Akutní bolest má 3 komponenty:
- Aferentní nociceptivní stimulace;
- Interpretace signálů vyššími centry (včetně ovlivnění paměti a a bolestivé zkušenosti);
- Emotivní a afektivní jednání (strach, deprese).
Silný stres je vyvolán nejen samotnou bolestí, ale kromě operace a úrazu také chorobou, která k bolesti vedla. Proto je nezbytné synergické řešení kauzální i symptomatické.
Schéma vzniku reflexů při akutní bolesti je následující:
- Akutní poškození tkáně →
- Uvolnění PG1, histaminu, serotoninu, bradykininu, subst. P →
- Iritace nociceptorů →
- Převod A∂ a C vlákny do míchy →
- Segmentální, suprasegmentální a korové odpovědi.
Psychologické účinky akutní bolesti:
- Akutní bolest způsobuje krátkodobé změny – obavy, strach;
- Nedostatečné tlumení akutní bolesti tyto změny prohlubuje;
- Nespavost vede k pomalému zotavování;
Velmi často jsou příčinou akutní bolesti stavy po operačních výkonech. Tuto poperační bolest ovlivňují tyto faktory:
- Místo, typ a konání operačního výkonu;
- Typ a rozsah chirurgického zákroku;
- Fyziologický a psychologický stav pacienta;;
- Předoperační psychologická a farmakologická příprava;
- Chirurgické komplikace;
- Peroperační tišení bolesti;
- Kvalita pooperační péče.
Význam pooperačního tišení bolesti: zmírňuje utrpení, umožní časnější rehabilitaci, zkracuje dobu hospitalizace, snižuje pooperační komplikace a celkově zlepšuje výsledky pooperační léčby.
Bolest je pátou vitální známkou (5.) po čtyřech dalších známkách:
- Stav vědomí;
- Dýchání;
- Oběh;
- Metabolismus.
- (Bolest.)
Chronická bolest
Chronická bolest nemá přesnou definici. Stává se však jednou z civilizačních nemocí. U bolesti akutní je skutečné poškození tkáně, u bolesti chronické se chronicita projevuje v potenciálním poškození tkáně, nebo je popisována výrazy pro takové poškození tkáně.
Senzoricko-diskriminační komponenta je u chronické bolesti podobná bolesti akutní. Bolest začíná na periférii, je vedena z nocisenzorů (nociceptorů, nocireceptorů) do míchy pomalu vedoucími nemyelinizovanými C-vlákny ( 0,5 – 2 m/s) nebo slabě myelinizovanými vlákny A∂ (12 – 30 m/s). V míše se přivádí do zadních rohů míšních do oblasti Rexedových zón. Už v této oblasti je určitá algeziotopie. Bolest povrchová a akutní se především vede do povrchových zón – substantia gelatinosa Rolandi ( I.a II. Rexedova zóna) a nucleus proprius ( I.,II. a III. Rexedova zóna). Hluboká bolest se vede do hlubších Rexedových zón ( vrstvy IV, V, VII, VIII a X) (obrázek: http://img.mf.cz/906/697/204.jpg).
Na vyšších etážích se chronická bolest, a zejména hluboká viscerální bolest, vede jinými drahami. Postupuje drahou spinoretikulotakamickou přes retikulární formaci do mediálních talamických jader – jader intralaminárních (centrum medianum, CM, nucleus centralis lateralis, CL, nucleus parafascicularis, pF). Odtud převážně směřuje do limbického systému, do inzuly, na mediální stranu frontálního laloku a také do gyrus cinguli, především do přední singulární kůry (anterior cingular cortex, ACC). Je zajímavé, že do těchto oblastí se vede nejenom bolest, ale projikují se sem i charakteristiky, které souvisejí se stresem, a to jak pozitivní – radosti, tak negativní - potíže různého typu. Je to určitý check point stresových situací.
Pokud o bolesti platí, že její vnímání je subjektivní, platí to zejména o chronické bolesti.
Nejčastější situace a systémy, kdy se vyskytuje chronická bolest:
- Bolest pohybového aparátu.
- Bolesti hlavy.
- Bolesti obličeje.
- Bolesti u nádorových onemocnění.
- Fantomové bolesti.
- Bolesti po traumatech.
Chronická bolest způsobuje velké tělesné utrpení, je doprovázena psychologickými změnami a ovlivňuje kvalitu života. Chronické změny mohou vyvolat anxietu a deprese a samy o sobě mohou přejít do nemoci. I bolest bez zjevné příčiny vyvolává velké tělesné utrpení.
Chronická bolest je dnes považována za samostatné onemocnění, je považována za nozologickou jednotku onemocnění sui generis. Na počátku je zpravidla organická příčina, a i když později mizí, bolest pokračuje. Chronická bolest vyžaduje opakované a trvalé léčení.
Definice, podle které chronická bolest je taková, která trvá 3 – 6 měsíců, je nepřesná. Nemusí vždy platit. Bolest se může opakovat léta (angina pectoris, nebo trvale se opakující migrenózní záchvaty). Častým typem chronické bolesti je nenádorová chronická bolest. Jak u akutní, tak i u chronické bolesti musíme odstraňovat bolest a stres, snažit se o návrat k normálnímu životnímu stylu a nezanedbat vliv dlouhodobého působení užívaných léků.
Velmi častým zdrojem bolesti je chronická nádorová (maligní) bolest.. U ní se snažíme odstranit nádorové útvary či buňky, léčebně pak ovlivňujeme transmisi bolesti a její percepci v mozkové kůře a v limbickém systému záleží však na stavu organismu a délce předpokládaného života.
Chronické bolesti způsobují nejenom bolest, ale i utrpení. Každé utrpení může každou bolest jenom zhoršovat. Je doprovázeno dalšími stresovými faktory ( stresový circulus vitiosus) např. nespavostí a strachem. Jsou přítomny poruchy spánku , deprese, poruchy libida, nechutenství, zácpa - to vše vede ke zhoršené kvalitě života, sociální izolovanosti, ke změnám osobnosti, ztrátě zaměstnání a nebezpečí suicidia.
Jsou atakovány všechny složky řídících systémů (nejstarší imunologický, mladší endokrinní i nejmladší nervový s psychikou).
Bolest nociceptivní (nociceptorová, nocisenzorická) vzniká v nocisenzorech (vysokoprahových, polymodálních a ve vlastních receptorech bolesti, které jsou na zakončení aferentních nervových vláken (viz výše). Jsou citlivé na některé látky, které v buňkách generují proteiny tepelného šoku (heat shock proteins). Bolest nociceptivní může také probíhat chronicky, i když většina chronických bolestí je smíšená.
Neuropatická bolest je chronická bolest, která nezačíná na nocisenzorech, ale v primárních aferentních vláknech. To jsou nemyelinizovaná vlákna C (pomalé vedení vzruchu) a vlákna A∂ (rychlé vedení).
Mezi periferními vlákny vzniká efaptický přenos. Efapse znamená, že vzruchy přeskakují mezi vlákny. Tak vznikají neuropatie a polyneuropatie. To např. je častý příznak diabetické polyneuropatie. Příčinou efapse je pučení (sprouting), které se ve skupině paralelních nervových vláken objevuje při dlouhodobém bolestivém dráždění. Z vláken vypučí další větévky, které k sobě přibližují, takže vzruch může „přeskakovat“ nejenom na synapsích, ale i na takto nově vytvořeném paralelním spojení – efapsi (obrázek: http://img.mf.cz/904/697/203.jpg). Proto je léčení polyneuropatií tak obtížné. U neuropatické bolesti také nastává změna neuronálních odpovědí – elektrická aktivita neuronů v míše a mozku je chaotická (podobné je to u akutních bolestí). Při bolestivé stimulaci pak dochází k uspořádání odpovědí. U neuropatické bolesti se vyskytují rovněž kanalopatie, kdy se mění aktivita kanáů pro sodné, draselné a vápenaté ionty.
Efaptickému přenosu nemůžeme zabránit, ale musíme bolest tlumit na vyšších etážích v míše a v mozku. Bolest neuropatická je jednou z nejobtížněji léčitelných bolestí. V poslední době je možno tuto bolest tlumit lidokainovými náplastmi, kdy se tlumí vznik akčního potenciálu na periferních nervech.
Většina bolestí je smíšených nociceptivních i neuropatických.
Na centrálním zpracování bolesti se významně podílejí opioidní (dříve ne zcela označované jako morfinové nebo opiátové ) receptory, které jsou v míše umístěny spinálně i supraspinálně (nejdůležitější podtypy jsou označovány jako subtypy m, k a d). Později bylo zjištěno, že se na přenosu nocicepce podílejí i biogenní aminy, vyskytující se v CNS. Jedná se o noradrenalin, serotonin a případně i dopamin.
Při chronické bolesti se často uplatňuje i velmi často i psychosomatická složka. Psychosomatické působení lze vysvětlit tak, že psychický stav člověka a jeho psychologie mohou působit vznik somatických potíží. Psychosomatické onemocnění je častý příznak právě chronické bolesti.
Psychosomatická bolest však není psychogenní bolest. Psychogenní bolest je bolest,která se vyskytuje u psychicky nemocných lidí s psychiatrickými diagnózami, především schizofrenií, bipolární poruchou a depresí. Nezačíná na periférii, ani na nocisenzorech, ani na nervových vláknech, ale je generována v centrální nervové soustavě v oblasti limbického systému.
Dlouhodobý stres může vyvolat psychosomatické onemocnění. Stres způsobí především svalový spasmus a ten má tu vlastnost, že již při malé změně může nastat bolestivá reakce. Nejčastější jsou bolesti zad. Je známo, že 82 % populace trpí alespoň jednou za život bolestmi zad a 40 % z nich je psychosomatického původu. Tito lidé mají trvale zvýšený tonus svalstva a tím se jim uvolňují některé stresové hormony a nastávají změny, které mohou působit bolest. Ženy trpí bolestmi zad častěji a mají snížený práh bolesti.
U chronické bolesti může být stresová analgézie. Kromě opioidního systému jsou i další systémy, které mohou ovlivňovat bolest. Je to systém DNIC (difuze noxious inhibitory control), který začíná v prodloužené míše v předním ventrálním jádře. Aktivace tohoto systému tlumí bolest. Kromě zmíněných opioidů jsou ještě další modulátory bolesti: nociceptin, kanabioidy, oleomid, galanin, GABA, neuropeptid Y, orexin, dopamin, noradrenalin, ghrelin, glutamát, substance P, serotonin, chlecystokinin, neurotenzin, melanocortin anebo transkript regulovaný kokainem a amfetaminem (cocain and amfetamin regulated transcript, CART). Všechny tyto látky mají vliv na bolest.
Při léčení těchto psychosomatických potíží musíme používat vhodné psychologické metody. Psychoterapie je založena na tom,, že se uvolňují endogenní opioidy (β-endorfin, dynorfin, enkefaliny a endomorfin). V podstatě jde o využití efektu placebo. Efekt placebo je fyziologicky vysvětlitelný uvolňováním právě zmíněných látek. Má velký význam a každý lékař by jej měl ovládat a používat ho. Placebo efekt je znám celá staletí. Kromě lékařů jej používají různí léčitelé a lidé, kteří se snaží ovlivnit nemoci. Placebo efekt má nevýhodu v tom, že je pouze krátkodobý - musí se pořád opakovat. Je založen na důvěře v lékaře, nebo v léčitele, a na víře v účinek i dalších metod, které se v léčení používají. Pozor na opačný efekt – psychologicky můžeme také uškodit a vyvolat iatrogenní efekt.
Lokalizace a typy bolesti; rozdíly mezi somatickým a viscerálním čitím
Přesnost umístění bolesti závisí na přítomnosti receptorů, počtu zakončení, jiných smyslových modalitách a na zkušenosti pacienta. Bolest se špatně lokalizuje u dětí, velmi přesná může být u pacienta s opakovanými bolestmi. Povrchová (kožní) bolest je na povrchu kůže velmi přesná, hlouběji hůře lokalizovatelná. Přenesená bolest je umístěna do povrchových i hlubokých struktur, zásobených ze stejného nebo sousedního míšního segmentu.
Jak autonomní, tak somatický nervový systém se skládá z aferentních složek, centrálních integrační ústředí a eferentních drah. Viscerální útrobní aferentace má velký význam při udržování homeostázy. Vnitřní orgány obsahují množství speciálních receptorů – osmoreceptorů, baroreceptorů, chemoreceptorů atd., reagujících na změny vnitřního prostředí. Aferentní vlákna vycházející z těchto receptorů vytvářejí reflexní spojení a dráhy, které jsou zapojeny do řízení činnosti různých funkčních systémů.
Receptory pro bolest a ostatní modality čití ve vnitřních orgánech jsou podobné příslušným strukturám v kůži, ale výazně se od nich liší svým rozložením. Ve vnitřních orgánech nejsou žádné proprioreceptory a je zde málo receptorů pro teplo a dotyk. Po infiltrační anestézii břišní stěny je možno v otevřené břišní dutině manipulovat se střevy, mohou se řezat, a dokonce i pálit, aniž by byly vyvolány jakékoliv nepříjemné pocity. Receptory pro bolest jsou nicméně přítomny i v útrobách, i když v mnohem menším počtu než v somatických orgánech, a některé typy podnětů mohou i zde působit intenzivní bolest (zejména natažení tkáně nebo roztažení dutého orgánu).
Aferentní vlákna z útrobních orgánů přicházejí do centrálního nervového systému sympatickými a parasympatickými drahami. Buněčná těla neuronů jsou lokalizována v zadních kořenech míšních a v gangliích hlavových nervů téže strany. Přesněji specializovaná viscerální aferentní vlákna jsou obsažena v n. facialis, n. glossopharyngeus a n. vagus, dále v zadních kořenech hrudních a horních bederních segmentů a v kořenech křížových míšních segmentů. Viscerální aferentní vlákna z oka mohou probíhat v trojklanném nervu (n. trigeminus). Je méně zřetelné, že aferentní vlákna obsahující málo substance P jsou kolaterálami postgangliových sympatických neuronů spojena s neurony v sympatických gangliích, jakým je např. ganglion mezentericum inferior. Tato spojení mohou hrát roli při reflexní kontrole útrob nezávislé na centrálním nervovém systému.
Počitky z vnitřních orgánů jsou stejné jako počitky somatické. Jsou vedeny spinotalamickými drahami a dále jako talamická radiace do korových percepčních oblastí pro útrobní čití, která pravděpodobně jsou lokalizována společně se somatickými percepčními oblastmi (viz somatický Homunkulus).
Viscerální (útrobní) bolest
Útrobní bolest je obtěžující, různé intenzity, nezřídka spojená s nauzeou a vegetativními příznaky. Často vyzařuje do jiných oblastí anebo je do nich přenášena.
Vzhledem k tomu, že v útrobách je relativně málo bolestivých receptorů, je viscerální bolest nepřesně lokalizovaná. Přesto téměř každý z vlastní zkušenosti ví, že může být velmi krutá. Receptory ve stěnách dutých orgánů jsou obzvláště citlivé na jejich roztažení. V trávicím ústrojí lze bolest experimetnálně vyvolat nafouknutím spolknutého balónku spojeného s hadičkou. Tak vyvoláme bolest, jejíž intenzita střídavě stoupá a klesá (střevní kolika) tak, jak se střevo střídavě kontrahuje a relaxuje v okolí balónku. Podobnou koliku způsobují kontrakce dilatovaného střeva nad překážkou při střevní neprůchodnosti. Při zánětu nebo překrvení (hyperémii) některého vnitřního orgánupůsobí velmi silnou bolest již relativně slabé podněty. Jde pravděpodobně o jednu z forem primární hyperalgézie, podobnou té, která se při zánětech objevuje v somatických strukturách. Rovněž tah za mezenterium se považuje za bolestivý, ale význam tohoto pozorování při vyvolání viscerální bolesti není jasný. Viscerální bolest je nepříjemná nejenom proto, že ji provází afektivní složka, která je této podobná složce všech ostatních druhů bolesti, ale také proto, žeproce sem, který způsobuje bolest, je v činnost uváděno mnoho dalších viscerálních aferentních systémů, jež jsou součástí reflexních okruhů vyvolávajících zvracení a další vegetativní příznaky.
Svalový spasmus (křeč) a rigidita ( ztuhlost)
Viscerální bolest stejně jako hluboká bolest způsobuje reflexní kontrakci okolních kosterních svalů. Reflexní spasmus nejčastěji pozorujeme v břišní stěně. Projevuje se ztuhnutím (rigiditou) stěny. Je nejvýraznější, jestliže útrobní zánětlivý proces zasahuje i peritoneum. Je možné se s ním setkat i za jiných okolností. Anatomické detaily reflexních drah, jejichž prostřednictvím bolestivé vzruchy z nemocných vnitřních orgánů vyvolávají křečovité stahy kosterních svalů, dosud nejsou objasněny. Svalové spasmy chrání zanícené útvary, ležící pod nimi, před náhodnou traumatizací. Proto je tento reflexní spasmus také někdy nazván „ochranný“ nebo „strážný“.
Klasickými příznaky zánětu v břišní dutině jsou bolest, citlivost a vegetativní změny, jako jsou hypotenze, pocení a spasmus břišní stěny. Větší citlivost je způsobena zvýšením senzitivity bolestivých receptorů v útrobách, vegetativní změny jsou zprostředkovány aktivací viscerálních reflexů a křeč (spasmus) vzniká následkem reflexní kontrakce svalů břišní stěny.
Kořenová bolest
Vzniká iritací zadních míšních kořenů a z nich vystupujících nervů. Bolest zachvacuje celou inervační oblast postiženého nervu (areae radiculares).
Fantomová bolest
Je pociťována v amputované části těla. Reagující neurony mají změněný práh citlivosti a vzniká v nich množství podnětů, které jsou v CNS interpretovány jako bolest.Vzniká po ztrátě některé části těla, zejména končetin, tím, že v mozku je stále zachován určitý engram, do něhož se lokalizuje bolestivé vnímání, ačkoliv končetinu už vůbec nemáme. Bolí nás neexistující noha, prs, penis a podobně.. Zajímavé je také to, že, že fantomová bolest vzniká i při amélii, kdy se vůbec nevytvořily končetiny; fantómová bolest se vyskytuje u 13 % takto poškozených dětí. To znamená, že v mozkové kůře se vytváří nějaký engram reprezentace končetin již v embryonální době. „Končetina bolí, aniž poškozený jedinec měl jakoukoliv zkušenost s bolestivou končetinou.“ Tento jev zatím není vysvětlen.
Kauzalgie
Kauzalgie je způsobena poškozením tkáně nebo nervů, které bolestivě stimulují neuron v zadních rozích míšních. Bolestivé signály se přenášejí dále do vyšších mozkových center. Normálně nebolestivé podněty pak mohou vyvolat bolestivou reakci. Bolest může být provázena hyperalgézií a hyperestézií, vazomorickým a trofickým poškozením dané oblasti (posttraumatická neuralgie, Sudeckova analgodystrofie).
Neuralgie
Jako neuralgii označujeme bolestivé pocity šířící se podél kraniálních a spinálních nervů. Ostrá bolest může být vyvolána traumatem, infekčním procesem. Krutá je neuralgie trigeminu.
Hyperalgézie a hypoalgézie
Hyperalgézie je zvýšená citlivost na bolestivé stimuly. Může být součástí hyperestézie, což je zvýšená citlivost k somatosenzorickým stimulům (v užším smyslu pouze k mechanické a termální stimulaci). Při hypoalgézii je snížena citlivost na bolestivé stimuly. Hypoalgézie je součástí hypoestézie, tzn. snížené citlivosti k somatosenzorickým stimulům. Analgézie je absence citlivosti na bolestivou stimulaci. Často bývá často kombinována s poruchou ostatních modalit, ale může být i samostatná. Lze ji vyvolat podáním anestetik.
Hyperpatie
Hyperpatie je bolestivý syndrom, který je charakterizován zvýšenou reakcí na bolestivou stimulaci. Zvláště se projevuje při opakované stimulaci. Hyperpatie může být kombinovaná s hypoestézií, hyperestézií nebo dysestézií.
Alodynie
Alodynie je bolest způsobená nebolestivou stimulací normální tkáně (např. kůže) a vzniká při vyšší senzitizaci nociceptorů, takže normální mechanické anebo tepelné podněty způsobují bolestivý pocit.
Anodynie
Anodynie je syndrom ztráty vnímání bolesti (insuficience anebo absence nocicepce), zvláště v oblasti, kde předtím byla bolest vnímána. Vrozená forma anodynie, vrozená insenzivita bolesti, při níž je zachováno vnímání všech ostatních somatosenzorických kvalit, dokazuje, že existují specifický nociceptivní systém. Bolest tedy je samostatná senzorická entita. Pacient je izolovaně poškozený. Vrozená insenzivita je velmi vzácná (200 případů na světě).
Přenesená bolest (referred pain) a vyzařování (iradiace) bolesti
Dráždění útrob často vyvolává bolest, která není pociťována přímo ve vnitřním orgánu, ale v jiných strukturách těla, které mohou být od primárního zdroje velmi vzdálené. Takovou bolest nazýváme bolestí přenesenou (referred) do jiných somatických struktur. Přenášet se může také hluboká somatická bolest, zatímco povrchová bolest nikoliv.
Jindy se podráždění z patologického ložiska nacházejícího se někde vysoko proximálně v průběhu nervu promítá (vyzařuje, iradiuje) do distálních oblastí, odkud aferentní nervová vlákna postiženého nervu normálně vedou vzruchy (typicky se dráždění vláken n. ischiadicus vyhřezlou ploténkou promítá do stehna anebo až distálních článků nohy). Rovněž jestliže je viscerální bolest pociťována jak lokálně, tak přeneseně, zdá se někdy, jako by se promítala (vyzařovala, iradiovala) z místa svého vzniku do místa, kam se přenáší.
Je samozřejmé, že znalost míst, kam se přenáší bolest z jednotlivých útrobních orgánů, je pro lékaře velmi důležitá. Pravděpodobně nejznámnějším příkladem je projekce bolestí ze srdce na vnitřní plochu levé paže. K jiným názorným příkladům patří bolest na vrcholku ramene, způsobená drážděním centrální částí bránice a bolest ve varleti způsobená nadměrným roztažením močovodu.
Podobné příklady lze nalézt v chirurgii nebo zubním lékařství. Přesto nejsou místa přenosu bolesti vždy stereotypní a často je možno se setkat s přenesením anebo projekcí bolesti, které jsou zcela neobvyklé. Např. bolest ze srdce může pacient udávat jako vysloveně břišní, lokalizovat ji do pravé paže anebo i do šíje. Projikovaná bolest může být vyvolána i experimentálně drážděním pahýlu splanchnického nervu.
Pravidlo dermatomů
Oblast periférie senzitivně inervovaná jedním zadním míšním kořenem (= jedním míšním segmentem) se skládá z oblasti kůže (dermatomu) a oblasti útrob a svalů inervovaných tímtéž zadním míšním kořenem. Zadní kořen tak vede jak somatosenzitivní, tak viscerosenzitivní vzruchy. Při vedení bolesti z útrob pak může dojít k tomu, že impulsy z orgánů jsou na úrovni spinálního ganglia anebo segmentu míchy převedeny na nervové dráhy vedoucí vzruchy z kůže, což vede k přecitlivělosti daného okrsku na dotek. Pokud takto dochází k přenosu nemoci, pak se to děje mezi útvary vzniklými z téhož embryonálního základu. Tento princip se nazývá pravidlo dermatomů. Okrsky typické pro jednotlivé vnitřní orgány se nazývají Headovy zóny.
Např. v průběhu embryonálního vývoje se bránice přesunuje ze šíjové oblasti do své dospělé polohy v břiše a nese si s sebou své nervové zásobení (nervus phrenicus). Jedna třetina jeho vláken jsou vlákna aferentní, která vstupují domíchy na úrovni druhého až čtvrtého krčního segmentu. Do stejných segmentů ovšem vstupují aferentní vlákna z vrcholu ramene. Stejmě tak mají tentýž segmentální původ srdce a paže, takže při infarktu myokardu se může bolest šířit na vnitřní stranu paže a na ulnární stranu levé ruky anebo i jinam (např. do dolní čelisti). Podobně varlata sestoupila i se svou inervací z primitivní urogenitální lišty, z níž pocházejí také ledviny a močovod, a proto se ledvinové koliky promítají do oblasti varlat.
U přenesené bolesti také hraje důležitou úlohu předchozí zkušenost. Ačkoli bolest mající svůj původ v zaníceném břišním orgánu je obvykle lokalizována ve střední čáře, pak u pacientů, kteří dříve prodělali břišní operaci, může být bolest pociťována v operační jizvě. Bolest ze sinus maxilaris se obvykle vnímá v okolních zubech, ale u pacientů, kteří měli v anamnéze traumatický dentální výkon, se tato bolest obvykle přenáší do zubů již dříve traumatizovaných. A to platí i tehdy, jestliže jsou zuby od sinusu dosti vzdálené.
Význam konvergence
Nejenže nervy z viscerálních orgánů vstupují do nervového systému na téže úrovni jako nervy z oblastí, kam se bolest z určitého orgánu přenáší, ale periferní nervy také obsahují mnohem více senzorických vláken, než kolik axonů stoupá vzhůru v laterálních spinotalamických drahách. Proto musí nutně docházet ke konvergenci periferních senzorických vláken na spinotalamických neuronech v zadních rozích míšních. Na této skutečnosti je založena jedna z hypotéz vysvětlujících mechanismus fenoménu přenesené bolesti. Předpokládá, že somatická a viscerální aferentní vlákna konvergují na těchže spinotalamických neuronech. Protože somatická bolest je častější než bolest viscerální, mozek se „naučil“, že informace přicházející po určité dráze jsou vyvolány bolestivým podněte určité somatické oblasti. Jestliže je tatáž dráha stimulována aktivitou viscerálních aferentních vláken, pak mozek nečiní rozdíl a opět lokalizuje bolest do somatických oblastí.
Vliv facilitace
Jiná teorie původu přenesené bolesti předpokládá, že podprahové impulzy z viscerálních orgánů snižují facilitací v sublimitní oblasti práh dráždivosti spinotalamických neuronů, které přijímají aferentní vlákna ze somatických oblastí. Následkem toho se slabé podněty z těchto oblastí, jejichž aktivita by normálně vyhasla již v míše, dostávají do mozku.
Pokud by se přenos bolesti dal vysvětlit pouhou konvergencí, pak by prokainová anestézie somatické oblasti, do níž je bolest lokalizována, na ni neměla mít žádný vliv. Jestliže by závisela na podprahové facilitaci, musela by po tomto zákroku vymizet. Účinky lokálních anestetik v oblastech přenosu bolesti však nejsou tak jednoznačné. Intenzivní bolest obvykle zůstává neovlivněna, ale bolest střední intenzity může účinkem anestetik kompletně vymizet. Je velmi pravděpodobné, že v přenesené bolesti mají velký význam jak konvergence, tak i facilitace.
Inhibice a facilitace bolesti
J e velmi dobře známo, že vojáci, kteří jsou zraněni v bitvě, nemusí cítit bolest až do skončení boje (stresová analgézie). Mnoho lidí ví, že dotyk nebo hlazení poraněné oblasti snižuje bolestivost poraněného místa. I stimulace elektrickým vibrátorem v místě bolesti může částěčně zmírnit bolest. Akupunktura je používána déle než 4000 let, a to i jako jediná anestézie při operacích.
Tato a další pozorování naznačují, že v percepci a přenosu bolesti mají důležitou úlohu také útlum, inhibice anebo modulace. Právě zmíněný účinek interferujícího dráždění lze vysvětlit útlumem centrálních senzorických drah. Stimulace kůže nad oblastí viscerálního zánětu vyvolá zmírnění bolesti. Na tomto princippu účinkují i starobylé křenové placky.
Hradlové (vrátkové, gate) mechanismy v zadních kořenech
Na periférii se odehrává množství dějů, a proto je možné tlumit bolest už na této úrovni. Jsou známy analgetické prostředky jako chlazení, které zabraňuje senzitizaci receptorů a rozvoji zánětů, lokální anestetika, která blokují iontové sodíkové kanály, transkutánní elektrická stimulace (TENS), která tlumí bolest podobně jako elektroakupunktura. Akupunktura pak především zvyšuje hladinu opioidů a aktivitu opioidních receptorů.
Periferní stimulace pouze silných vláken typu A omezuje (uzavírá) postup bolestivých vzruchů cestou zadních kořenů a zadních rohů do spinotalamické dráhy (obrázek: http://img.mf.cz/902/697/202.jpg). Stimulace tenkých vláken typu C vrátka k postupu otevírá. Místem takového útlumu přenosu bolestivých vzruchů jsou zadní kořeny a zadní rohy míšní (hradlo, vrátka, brána, gate) (Melzach a Wall, 1965), přes která vzruchy přecházejí do laterálního spinotalamického systému. Dráždění silných aferentních vláken z oblastí, z nichž bolest pochází, snižuje bolest. Kolaterály odbočující z vláken zadních provazců vcházejí do kontaktu s vlákny vstupujícími do substantia gelatinosa a předpokládá se, že impulzy z těchto kolaterál, nebo interneuronů, na nichž také končí, inhibují přenos bolestivých vzruchů z vláken zadních kořenů do spinotalamických neuronů v zadních míšních rozích. Vnitřním mechanismem zřejmě je presynaptická inhibice na zakončeních primárních aferentních vláken, která přinášejí bolestivé vzruchy.
Mechanismus transdukce podráždění na volných nervových zakončeních není znám. Nociceptory regulují své prostředí prostřednictvím chemických mediátorů syntetizovaných v těle neuronů a transportovaných k vlastním zakončením. Po depolarizaci se mediátory volných nervových zakončení uvolňují a působí zarudnutí, teplo (dilatace periferních cév) a otok (průnik a akumulace tekutin).
Opakovaná aplikace škodlivých podnětů v okolí nociceptorů vede k jejich senzitizaci několika mechanismy. Poškozená tkáň uvolňuje kyselinu arachidonovou a mediátory jako prostaglandiny, leukotrieny, bradykinin, histamin, acetlcholin anebo substanci P, které snižují práh dráždivosti nociceptorů anebo je přímo stimulují (histamin stimuluje polymodální receptory). Prostaglandin E2 je metabolit arachidonové kyseliny a je produkován enzymem cyklooxygenázou (arachidonová kaskáda). Aspirin cyklooxygenázu blokuje.
Primární aferentní vlákna pak používají glutamát (typ receptorů AMPA) a neuropeptidy (substance P). Malá primární aferentní vlákna obsahují oba typy mediátorů. Neuropeptidy zvyšují účinek glutamátu, difundují od místa svého uvolnění na značné vzdálenosti (chybí reuptake), a proto se v některých případech podílejí na ztížené lokalizovatelnosti bolesti.
Při dlouhodobém dráždění se na míšních neuronech vedle AMPA aktivují také NMDA glutamátové receptory a rozvíjí se centrální hyperalgézie (přecitlivělost na bolest).
Kontrola nocicepčních signálů ve vyšších etážích centrálního nervového systému
Kontrola nocicepčního vstupu pravděpodobně existuje na všech úrovních NS. Na míšní úrovni je přenos informace z primárních aferentních vláken presynapticky inhibován prostřednictvím aktivace velkých myelinizovaných aferentních vláken z mechanoreceptorů (hradlo). Podobný mechanismus zřejmě existuje i na vyšších úrovních (obrázek: http://img.mf.cz/911/697/206.jpg). Hradlové mechanismy (tlumení bolesti) jsou tedy nejenom v míše, ale také ve vyšších strukturách centrálního nervového systému.
- V míše je to substantia gelatinosa Rolandi (ascendentní inhibiční systém).
Navíc kromě ascendentních drah existuje také účinná kontrola nocicepčních podnětů sestupnými drahami mozku, které inhibují odpovědi lokálních i projekčních nocicepčních neuronů.
Descendentní inhibiční systémy sestupující z vyšších struktur mozku jsou následující:
- Opioidní systém. Vychází z locus coeruleus.
- Adrenergní systém. Taktéž vychází z locus coeruleus.
- Serotoninergní systém. Vchází z mozkového kmene (nc. raphae magnus, nc. reticularis gigantocerularis).
- Vlákna DOPA ze substantia nigra, hypotalamu a diencefala.
- V experimentu je možná tkaé přímá stimulace některých struktur mozku.
Některé z těchto systémů selektivně inhibují nocicepční podněty, jiné jsou neselektivní a mají spíše „damping down“ efekt. Uvedené biogenní aminy v drahách, které je obsahují, také mají významnou funkci při řízení spánku, pozornosti, orientačním chování apod.
Descendentní dráhy začínají především v periakveduktální šedi (PAG) a v jádrech raphe (nc. raphe magnus a nc. raphe dorsalis). V těchto místech je největší produkce endorfinů a dynorfinů. Dalšími látkami, které ovlivňují bolest, jsou estrogeny, které blokují aktivitu NMDA receptorů v míše. NMDA receptory facilitují přenos bolestivého vzruchu míchou. Hladina endorfinů a enkefalinů a vliv estrogenů vysvětlují rozdílnou reakci na bolest u mužů a u žen (popř. u samců a samic). U žen je logicky vyšší hladina estrogenů, ale také vyšší hladina endorfinů, zejména v období před porodem a při něm, a hladiny dále kolísají během menstruačního cyklu. To vysvětluje, proč ženy mají nižší práh bolesti, a přesto se s bolestí lépe vyrovnávají než muži.
Klinické hodnocení intenzity bolesti
Pro bolest coby subjektivní vjem neexistuje žádné její objektivní měření. Každé měření bolesti je proto závislé na vnímání bolesti pacientem. Je u každého pacienta individuální. Způsobů hodnocení je hodně, známé jsou zejména 3 sysstémy. Jsou uvedeny níže.
Virtuální analogová škála (VAS)
- Pacient vyznačí intenzitu bolesti na úsečce, znázorňující kontinuitu bolesti od „ žádné“ po „ nesnesitelnou“ bolest.. Úsečka může být horizontální nebo vertikální, znázonění může být ve formě trojúhelníku.
Verbální škála – slovní hodnocení
Pacient udává bolest ve škále od 0 do 4:
- 0 = Žádná bolest.
- 1 = Malá bolest.
- 2 = Střední bolest.
- 3 = Silná bolest.
- 4 = Nesnesitelná bolest.
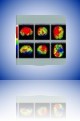
Obličejová (výrazová) škála
Je vhodná u pacientů se zhoršenou schopností komunikace. Původně byla navržena k hodnocení bolesti u dětí. Je složená ze série 10 obličejů, které odrážejí změny mimiky podle intenzity bolesti od stavu pohody až po nejvyšší utrpení. Pacient vybírá obličej, který nejlépe vyjadřuje závažnost jeho bolesti.
Terapeutické ovlivění bolesti
Bolest je buď nociceptivní, která začíná na nocisenzorech, nebo neuropatická (neurogenní), která vzniká až v průběhu nervů. Nemusí tedy vznikat jen na nocisenzorech, ale i v drahách bolesti (především neuritidy). Neuropatické bolesti jsou obtížně léčitelné a léčíme je jinak než než bolesti senzorického původu.
Míšní úroveň
Na míšní úrovni můžeme bolest ovlivňovat několika způsoby - intrathekální aplikací některých látek, např. kortikosteroidů nebo opioidů, ale i stimulačními metodami (obrázek: http://img.mf.cz/908/697/205.jpg). Používá se stimulace anterolaterálního traktu o vysoké frekvenci 150 – 200 Hz, po níž přestává zejména bolest cévního původu. Velmi dobře se tato metoda uplatňuje u anginy pectoris a dalších cévních bolestí. Na míšní úrovni můžeme použít i některé chirurgické operace, např. DREZ (dorzal root entry zone). Provádí se při těžké potraumatické deaferentační bolesti, při níž se vytrhaly zadní míšní kořeny. Koaguluje se 5 prvních Rexedových zón, a tím bolest zmizí. Je to jedna z operací, které se na míše dosud provádějí.
Úroveň podkoří a mozkové kůry
Dalšími oblastmi ovlivňování bolesti jsou talamus a mozková kůra. Zde můžeme bolest ovlivňovat působením opioidů, ale také některých látek, které se používají i k léčení jiných chorob. Využívají íse např. bicyklická antidepresiva. Mezi bolestí a depresí je velmi těsný vztah. Chronická bolest jako samostatná nozologická jednotka má často za následek vznik deprese. Naopak, dlouhodobá deprese může způsobovat chronickou bolest. Je to dáno tím, že obětyto choroby mají společné receptory NK1 (neurokininové receptory 1), které jsou nejenom v centrálním nervovém systému, ale i na periférii. O tom svědčí také to, že bicyklická antidepresiva velmi dobře ovlivňují některé typy chronických bolestí. Podobně působí i látky typu antiepileptik. Ty byly původně vyvinuty jako antikonvulziva, ale dnes se úspěšně používají i k léčbě bolesti na úrovni talamu a mozkové kůry.
Byla dlouhodobá snaha léčit bolest zákroky koagulací nebo stimulací některých talamických jader - nc. ventroposterolateralis inferior (VPi) a mediodorzalis (MD). Zákroky se ale neosvědčily tak jako při léčení Parkinsonovy choroby. Talamická bolest je velmi traumatizující bolestí, vzniká při infarktech talamických artérií. Je velmi úporná, nezabírá na analgetika a dosud používaná koagulace talamických jader ničí i všechny jejich ostatní funkce.
Bolest je daleko svízelněji léčitelná podkorovou stimulací, korová stimulace byla úspěšnější. Při ní se stimuluje nefrontální mozková kůra katodou a anody jsou umístěny na gyrus postcentralis. Používá se nízkofrekvenční stimulace (25 – 50 Hz ). Velmi dobře se tlumí nejen bolest deaferentační, ale i fantomová a talamická. Výklad mechanismu působení není znám. Zřejmě se podráždí motorická jádra v talamu, která jsou velmi bohatá na GABA. Tento účinek se zřejmě může z talamu šířit do dalších částí mozku, především do limbického systému, který tlumí.
Stimulací provokovaná analgézie
Při výkladu patofyziologie bolesti už výše bylo uvedeno, že existují tělu vlastní tlumivé mechanismy bolesti. Experimentální elektrická stimulace určité oblasti mozkového kmene, zejména periakveduktální šedé hmoty (PAG), vyvolává tak silnou analgézii, že zvířata mohou být operována i bez narkózy. PAG vysílá axony do nc. raphe magnus, tedy do místa, odkud vycházejí serotoninergní sestupná vlákna. Stimulace periakveduktální šedi tak způsobí inhibici míšních neuronů, které jsou odpovědné za převod nocicepčních podnětů. Tyto experimentální výsledky ale nejsou v plné míře použitelné u lidí, neboť zejména jádra raphe se vyskytují v bulbární oblasti, kde hrozí vznik bulbárního edému.
Opiátová analgézie
Opiáty (morfin) mají silné analgetické účinky. Injekce morfia do PAG produkuje silnou analgézii. Injekce serotoninu před injekcí morfinu anuluje efekt morfinu. Receptory pro opiáty byly nalezeny v mnoha částech NS. Mozek má zdroj svých vlastních peptidů příbuzných opiátům – enkefalinů, endorfinů a dynorfinů. Neurony s těmito peptidy jsou v mnoha strukturách NS včetně těch, které mají značný vztah k nocicepci. V oblastech, kde je přítomna periakveduktální šedá hmota, je také vždy velká produkce endorfinů. Endorfiny jsou endogenní morfiny, které se uvolňují právě při různých bolestivých stavech. Obsazují opioidní receptory, a tím tlumí bolest. Kromě endorfinů (zejména β-endorfinu) jsou i další látky – v míše enkefaliny a v mozku dynorfiny. V poslední době byly z mozhku izolovány také endomorfiny (endomorfin 1 a endomorfin 2). Je známo, že endomorfiny se zvyšují při některých bolestivých stavech, zejména při porodu, nebo v určitých fázích menstruačního cyklu. Zvyšují se ale také při jakékoliv fyzické aktivitě, zejména při sportu, ale také při psychické aktivitě, např. při sledování sportovních zápasů. Platí to pro hráče i pro diváky, markantnější zvýšení je při výhře.
Od vrátkové teorie k žebříčku bolesti
Za první vědecký základ léčby bolesti je pokládána hradlová neboli vrátková teorie bolesti (Melzack a Wall, 1965). Významnou událostí ovlivňující strategii léčby bolesti se stalo vydání tzv. Třístupňového žebříčku léčby bolesti (WHO, 1986). Strategie byla původně zaměřena na léčbu onkologických bolestí, Třístupňový žebříček však byl záhy plně přijat i pro léčbu bolesti neonkologické. Jednoduchým a názorným způsobem vyjadřuje vhodný postup pro léčbu bolestí různé intenzity. Na tomto podkladě vznikaly první metodické pokyny doporučené pro léčbu silné bolesti nenádorového původu s použitím silných opioidů.
Základem Třístupňového žebříčku je doporučení, podle kterého se při léčbě bolesti postupně posouváme od méně silných látek k silnějším a zkoušíme jejich různé kombinace. Cílem je dosáhnout kvalitního utlumení bolesti při co nejnižší dávce co nejslabších analgetik, které zaručí nejnižší vedlejší účinky léčby. Při zhoršující se bolesti u nádorových i nenádorových procesů postupně zvyšujeme dávky i typy léků a stoupáme tak pomyslně po analgetickém žebříčku nahoru.
Léčiva používaná při terapii bolesti:
- Neopiátová analgetika;
- Opiáty;
- Lokální anestetika.
Analgetický žebříček vypadá takto:
- 1. Volba: Nesteroidní antirevmatikum (+ pomocné léky);
- 2. Volba: Slabý opioid + nesteroidní antirevmatikum (+ pomocné léky);
- 3. Volba: Silný opioid + nesteroidní antirevmatikum (+ pomocné léky).
Schéma farmakologické terapie bolesti dle WHO je následující:
- Stupeň 1 – Neopiátová analgetika (Paracetamol, Metamizol);
- Stupeň 2 – Středně silný opiát + neopiátové analgetikum (Tramadol, Codein) + neopiátová analgetika;
- Stupeň 3 - Silný opiát + středně silný opiát (Morfin, Oxycodon) + neopiátová analgetika.
Původně relativně jednoduchá představa o funkci hradlového (vrátkového) systému, tj. představa ovlivňování transmise bolestivých vzruchů do vyšších etáží CNS v závislosti na poměru aferentací z tenkých nebo silných vláken, byla později modifikována. Velmi citlivé biochemické a farmakologické ovlivňování „hradla“ je podmíněno složitými a dosud ne zcela objasněnými kooperativními účinky látek, které v zadních míšních rozích modulují přenos vzruchů bolesti ze zakončení primárních aferentních neuronů na neurony na ně navazující. Na neurotransmisi v zadních rozích míšních se podílejí významnou měrou neuropeptidy, např. substance P, neurokinin A, calcitonin gene related peptid (CGRP), enkefaliny a další. Vedle toho se zde uplatňuje řada jiných mediátorů, jako např. kyselina γ-aminomáselná kyselina (GABA), kyselina glutamová, biogenní aminy a další. Na procesu nocicepce se rovněž podílí purinergní neurotransmise (zejména adenosin). Zde byla pozornost především zaměřena na P2X nociceptory a na hledání jejich antagonistů. V souvislosti s potlačováním bolesti se v posledních letech navíc intenzivně studuje význam kanabinoidních látek, a zejména jejich CB1 receptoru. Kanabinoidní látky zřejmě mají vedle svých centrálních účinků i účinky periferní .
Vzhledem k dosud neobjasněným komplexním vzájemných interakcím jednotlivých neurotransmiterů a neuromodulátorů, navíc často komplikovaným nespecifickým účinkem používaných farmak, se ve většině případů nedaří samostatně a cíleně potlačovat bolest antagonisty jednotlivých alogenních substancí. Ve většině případů jsou proto farmakoterapeutické zásahy objasněny pouze částečně.
Obdobně složitá, spíše však ještě složitější, je situace v supraspinálním zpracování bolesti (tj. v úrovních nad míchou). I supraspinálně dochází k interakcím účinných látek. Významná je koperace substancí působících na opioidní receptory s noradrenergními a serotonergními systémy CNS, což bylo mj. potvrzeno zvýšením hladin metabolitů noradrenalinu a serotoninu v likvoru po aplikaci opioidů. Tyto výsledky napomohly objasnit významnou úlohu biogenních aminů v procesu bolesti. Navíc jsou v souladu s údaji o častějším výskytu algických syndromů u depresivních nemocných, nebo naopak o častějším výskytu deprese u nemocných s chronickou bolestí. Přerušit tento circulus vitiosus může pouze komplexní ovlivnění na více místech bolestivého procesu. Odtud vyplynula potřeba podávat farmaka z různých lékových skupin zasahující různá místa řetězce bolesti.
Další možnost léčby bolesti je léčba ozařováním. Je zejména účinná u kostních metastáz v bederní páteři, které jsou typické pro rakovinu prsu. Ozařování přináší zlepšení, ale prognóza se nemění.
Chirurgická léčba bolesti
Neúčinkují-li léky nebo ozařování, provede se radikální chirurgický zákrok směřující k přerušení drah vedoucích vzruchy bolesti.
Použitá literatura a literatura k dalšímu studiu
Kozák, Jiří: Chronická bolest a její léčba, Praha MZČR: 2002, 1-20
Rolnyba R.: Fyziologie a patofyziologie bolesti a její možné praktické výstupy. Prakt. Lék., 2000, 80 č. 7. S 372-377.
Rokyta, Richard: Patofyziologie bolesti. Postgraduální medicína 1/2003.
Albe Fessand: Bolest (Český překlad Rokyta R., Höschlerová K., Kúžová, A.) Praha Grada Publishing 1998.
Opatovksý J. Neuropatické bolesti- patofyziologické mechanizmy a terapie. Neurol. pro praxi. 2006; 5:270-274.
Zpracovala: Doc. MUDr. Květoslava Dostálová, CSc., Ústav patologické fyziologie LF UP v Olomouci.